
A.浓溶液 B.不饱和溶液
C.含有a g溶质 D.含有b g溶剂
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 (2011?顺义区一模)水是生命之源,通过化学学习,我们进一步认识了水的作用.
(2011?顺义区一模)水是生命之源,通过化学学习,我们进一步认识了水的作用.
| ||
| ||
| ||
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
查看答案和解析>>
科目:初中化学 来源:2007年威海市初中毕业升学统一考试 化学试题 题型:058
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目:初中化学 来源:2013-2014学年山东省泰安市泰山区九年级上学期期末考试化学试卷(解析版) 题型:填空题
下表是KNO3、NaCl在不同温度下的溶解度。
|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
KNO3 |
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
245 |
|
NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
(1)依据上表数据,绘制KNO3、NaCl的溶解度曲线,下图1中能表示KNO3溶解度曲线的是_________________。(填“a”或“b”)
(2)下图1中P点的含义是__________________________________。

(3)欲使硝酸钾不饱和溶液转化为饱和溶液,可以采取的方法之一是_______________。
(4)30℃时,在两个各盛有100g水的烧杯中,分别加入相同质量的氯化钠和硝酸钾,充分溶解后,其结果如上图2所示,加入的甲物质是_________________。

(5)硝酸钾中含有少量氯化钠时,可通过_________________(填“蒸发结晶”或“降温结晶”)的方法提纯。
(6)20℃时,136g饱和食盐水,蒸发10g水后,再降温到20℃,可析出NaCl晶体的质量为________g。
(7)60℃时,将60g硝酸钾放入盛有50g水的烧杯中,充分搅拌,所得溶液的质量为________g。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
追踪科学家的足迹
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标。下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4CI晶体,过滤,得到NH4CI。
材料2:四种盐在不同温度下的溶解度表。
|
盐 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4CI | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
试回答下列问题:
(1)在实验室中,你选择的制备C02反应的化学方程式为 。在工业生产中,要获得生产纯碱的原料CO2 你认为最经济实用的方法是以 为原料,该反应的化学方程式为 。
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是 。
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是 。
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同。) 。在③中,将析出的晶体过滤后,溶液中数量减少的离子有 ;滤液中仍然存在的离子有 。②中反应的化学方程式为 。
(5)在20 ℃时,向含NH4HC03 21 g的饱和溶液中加入足量食盆。试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4CI晶休析出?理论上能析出多少克NaHCO3?(友情提示:本小题没有计算过程不得分.可能用到的相对分子质量:NH4HC03: 79; NaCl: 58.5; NaHC03: 84-, NH4CI: 53.5)。
查看答案和解析>>
科目:初中化学 来源: 题型:
水是生命之源,通过化学学习,我们进一步认识了水的作用。
(1)水和蛋白质、油脂、维生素以及 是人体所需的六大类营养素。
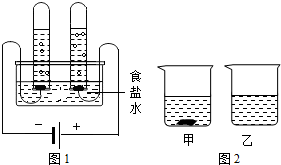
(2)水是重要的工业原料。工业上可用电解水的方法制取氢气,反应的化学方程式为 。用右图所示的装置电解食盐水,可发生如下反应:
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,与电源正极相连的试管内收集到的气体是 ,向反应后的溶液中滴加紫色石蕊,观察到的现象是 。
2NaOH+H2↑+Cl2↑,与电源正极相连的试管内收集到的气体是 ,向反应后的溶液中滴加紫色石蕊,观察到的现象是 。
(3)水是很好的溶剂。下表列出了氯化铵和氯化钠在水中的溶解度,回答问题。
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
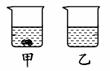
①40 ℃时,向两个分别盛有45 g NH4Cl和N![]() aCl的烧杯中,各加入100 g的水,充分溶解后,结果如右图所示,则乙烧杯中的溶质是 。
aCl的烧杯中,各加入100 g的水,充分溶解后,结果如右图所示,则乙烧杯中的溶质是 。
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法正确的是________(填字母)。
A.溶剂质量可能不变 B.溶液中溶质的质量分数一定减小
C.溶液质量一定增大 ![]() D.溶液中溶质的质量分数可能增大
D.溶液中溶质的质量分数可能增大

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com