
| A. | 向某溶液中先滴加稀盐酸,没有明显现象,再滴加氯化钡溶液,生成白色沉淀,则该溶液中一定含有硫酸根离子 | |
| B. | 用玻璃棒蘸取食用白醋滴在润湿pH试纸上,测定其pH | |
| C. | 将H2、O2的混合气体通过盛有灼热氧化铜的试管,以除去氢气 | |
| D. | 除去氯化钠中的硝酸钾,加水后过滤 |
分析 A、根据检验出某酸溶液或可溶性盐中含有SO42-,加盐酸排除了银离子和碳酸根离子的干扰进行分析;
B、根据测定pH值的正确方法进行分析;
C、根据氢气和氧气的混合气点燃可能发生爆炸进行分析;
D、根据氯化钠、硝酸钾都溶于水进行分析.
解答 解:A、向样品中加入稀盐酸,没有任何现象,说明一定没有Ag+,再加入少量BaCl2溶液,生成白色沉淀,此时溶液为酸性,而BaSO4既不溶于水也不溶于酸,则白色沉淀为BaSO4,溶液中一定含有SO42-,方案可行,故A正确;
B、pH试纸测定溶液pH值时,不能湿润,故B错误;
C、氢气和氧气的混合气点燃可能发生爆炸,故C错误;
D、氯化钠、硝酸钾都溶于水,除去氯化钠中的硝酸钾,加水后过滤,不能除去,故D错误.
故选:A.
点评 本题考查了两种固体混合物分离顺序的评价,混合物分离是初中化学的一个难点,解题关键是抓住混合物中的物质特点.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 倒入澄清石灰水 | B. | 用带火星的木条 | C. | 用燃着的木条 | D. | 用燃着的红磷 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 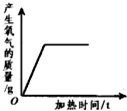 | B. | 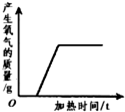 | C. | 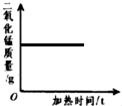 | D. | 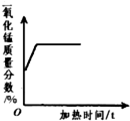 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com