
| 实验图示 | 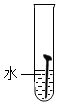 | 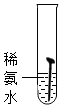 | 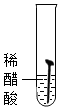 | 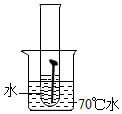 | 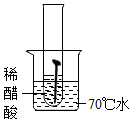 |
| 生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |
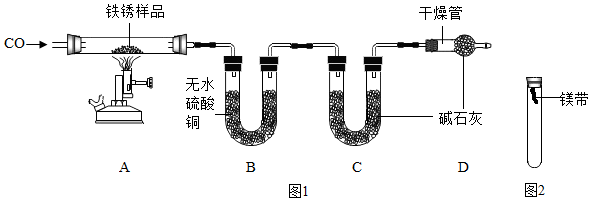
| 铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
| 反应前 | 23.2 | 232.4 | 198.2 |
| 反应后 | / | 239.6 | 211.4 |
分析 (1)根据表格中的信息来分析解答;
(2)根据一氧化碳有毒来分析;
(3)根据实验的注意事项来分析;
(4)根据质量守恒定律来分析;
(5)根据质量守恒定律与化学方程式来分析;
(6)根据探究金属锈蚀的方法来分析;
(7)根据质量守恒定律以及化学方程式的写法来分析.
解答 解:(1)对比实验1和实验4,实验3和实验5可知,温度越高铁钉生锈速率越快;对比实验1、2、3可知,铁钉在酸性环境中锈蚀较快;故填:快;酸性;
(2)尾气中含有有毒的一氧化碳气体,该装置中没有将其处理;故填:;没有进行尾气处理
(3)一氧化碳具有可燃性,不纯时加热或点燃易发生爆炸,所以先通入CO一段时间,排净装置内的空气;故填:排尽装置内的空气,防止发生爆炸;
(4)无水硫酸铜能吸收水而变蓝,将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,这说明了反应后有水生成,说明铁锈中含有氢元素,也就是铁锈蚀的过程中有水参与;故填:氢;水;
(5)硬质玻璃管内发生反应的化学方程式为:FexOy•nH2O+yCO$\frac{\underline{\;高温\;}}{\;}$xFe+yCO2+nH2O,根据实验数据可知,反应中生成水的质量为:(239.6g-232.4g)=7.2g,生成二氧化碳的质量为:(211.4g-198.2g)=13.2g.设参加反应的CO的质量为w,则
FexOy•nH2O+yCO$\frac{\underline{\;高温\;}}{\;}$xFe+yCO2+nH2O
28y 44y
w 13.2g
$\frac{28y}{44y}=\frac{w}{13.2g}$
w=8.4g
由质量守恒定律可知,生成铁的质量为:23.2g+8.4g-13.2g-7.2g=11.2g;
由于反应前后元素的种类与质量不变,所以23.2gFexOy•nH2O中含铁元素的质量为11.2g;含有“H2O”部分质量为7.2g;则余下的氧元素质量为:23.2g-11.2g-7.2g=4.8g
则:x:y:n=$\frac{11.2g}{56}$:$\frac{4.8g}{16}$:$\frac{7.2g}{18}$=2:3:4,则FexOy•nH2O的化学式为Fe2O3•4H2O.
D装置中的碱石灰既能吸收水也能吸收CO2,防止了空气中二氧化碳与水被装置C吸收而造成质量偏大,若没有装置D,则装置C因为吸收了空气中的水蒸气和二氧化碳而质量偏大,由此计算出的二氧化碳质量偏大,导致氧元素的质量偏大,x:y的值偏小;故填:4;偏小;
(6)通过实验探究镁带在空气中锈蚀的条件,应该选择这样几组实验:④O2和CO2;⑤CO2和水;⑥O2和水;⑦O2、CO2和水四组实验进行对比;故填:④⑤⑥⑦;
(7)由镁带在空气中锈蚀,生成碱式碳酸镁[Mg3(OH)2(CO3)2]可以推测,是镁与氧气、水和二氧化碳反应生成了碱式碳酸镁;故填:6Mg+3O2+4CO2+2H2O=2Mg3(OH)2(CO3)2.
点评 本题探究了金属的锈蚀,解题时根据铁的锈蚀因素的探究方法、质量守恒定律、有关化学方程式的计算、化学方程式的书写方法分析解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
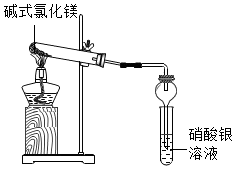 碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 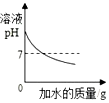 向一定量氢氧化钠溶液中滴入水 | |
| B. | 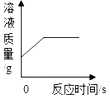 向一定量氯化铜溶液中加入一定量铝 | |
| C. | 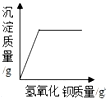 向一定量盐酸和硫酸钠混合溶液中滴入氢氧化钡溶液 | |
| D. | 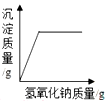 向一定量硫酸和硫酸铜混合溶液中滴入氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO3 | ||
| C. | CO2+H2O═H2CO3 | D. | CuSO4+2NaOH═Na2SO4+Cu(OH)2↓ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
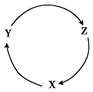 自然界的物质会发生变化,且变化有一定规律.根据物质转化的规律判断,下列各组物质中,能满足下图一步转化关系的选项是( )
自然界的物质会发生变化,且变化有一定规律.根据物质转化的规律判断,下列各组物质中,能满足下图一步转化关系的选项是( ) | 选项 | X | Y | Z |
| A | H2 | O2 | H2O |
| B | Cu | CuO | CuSO4 |
| C | C | CO2 | CO |
| D | CO2 | Na2CO3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 烯合金是一种新型材料 | B. | 烯合金具有优良的导电性 | ||
| C. | 石墨烯在常温下化学性质活泼 | D. | 石墨烯在一定条件下能与氧气反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com