含有少量铜粉的氢氧化镁粉末(均匀混合),其中镁元素的质量分数为40%.取该混合物粉末30g与一定量的20%的硫酸恰好完全反应,求反应后所得溶液的溶质质量分数?(计算结果保留两位小数)
【答案】
分析:根据混合物中镁元素的质量分数为40%,先计算出混合物粉末30g含有氢氧化镁的质量;再根据氢氧化镁与硫酸的反应方程式分别计算出参与反应的硫酸的质量与生成硫酸镁的质量;再根据溶质质量分数的计算方法进行解答.
解答:解:设氢氧化镁的质量为xg
Mg(OH)
2~Mg
58 24
x 30g×40%=12g
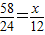
解答 x=29g;
设反应的硫酸的质量为y,硫酸镁的质量为z.
Mg(OH)
2+H
2SO
4═MgSO
4 +2H
2O
58 98 120
29g y z
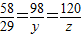
解答 y=49g,z=60g;
硫酸溶液的质量为 49g÷20%=245g
硫酸镁溶液的质量为 29g+245g=274g
硫酸镁溶液的溶质质量分数为 60g÷275g×100%=21.90%
答:反应后所得溶液的溶质质量分数21.90%.
点评:本题考查学生根据化学反应方程式进行分析解题的能力,及对溶质质量分数的计算方法的理解与掌握.



 阅读快车系列答案
阅读快车系列答案