解:(1)由KNO
3和NaCl的溶解度曲线可知,在22℃时,KNO
3和NaCl的溶解度曲线交与一点,在此温度下,KNO
3和NaCl的溶解度相同.两种饱和溶液的浓度相同;
(2)由KNO
3的溶解度曲线可知,KNO
3的溶解度随温度的升高而明显增大.所以,从KNO
3的溶液中析出晶体,通常采用的方法是加热浓缩后,再降温到室温;
(3)由NaCl的溶解度曲线可知,在20℃时,NaCl的溶解度是36g,由溶解度的意义可知,在20℃时,在90g的水中能溶解NaCl的质量是32.4g>10g,在70g的水中能溶解NaCl的质量是25.2g<30g.所以:
烧杯1中溶质的质量分数是:
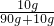
×100%=10%
烧杯1中溶质的质量分数是:

×100%=26.5%;
(4)设饱和KNO
3的溶液溶质质量分数为20%时的KNO
3的溶解度是x
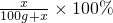
=20% 解得:x=25g
由KNO
3的溶解度曲线可知,在15℃时,KNO
3的溶解度是25g.所以,若要得到溶质质量分数为20%以上的KNO
3溶液,配制时的温度应不低于15℃.
故答为:(1)22℃;(2)加热浓缩后,再降温到室温.(3)见下表
(4)15.
分析:(1)根据KNO
3和NaCl的溶解度曲线的交点的意义分析;
(2)根据KNO
3的溶解度曲线随温度变化的情况分析结晶的方法;
(3)根据在20℃时,NaCl的溶解度的溶解度进行计算;
(4)根据KNO
3的溶解度与饱和溶液中溶质的质量分数分析计算.
点评:解答本题的关键是要知道溶解度曲线表示的意义,交点的含义,溶解度大小的比较,溶质质量分数的计算.

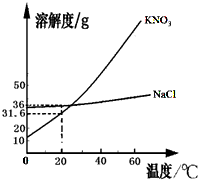 如图是KNO3和NaCl的溶解度曲线.据图回答:
如图是KNO3和NaCl的溶解度曲线.据图回答: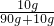 ×100%=10%
×100%=10% ×100%=26.5%;
×100%=26.5%;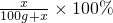 =20% 解得:x=25g
=20% 解得:x=25g 
