
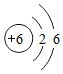
分析 (1)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2 的排放量.
(2)碳元素为质子数为6的元素,其原子的核外电子排布为2,4.其相对原子质量为12.01.
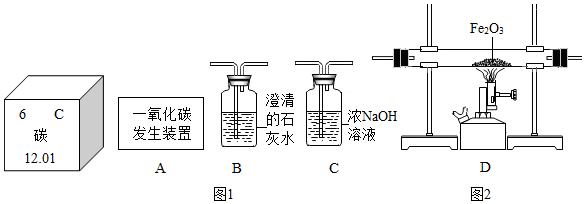
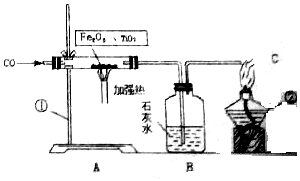
(3)利用图2装置可做CO还原Fe2O3的实验,并检验该反应生成的气体产物.已知由A装置制取的CO气体中混有少量的CO2.所以应该先除去二氧化碳然后在让一氧化碳和氧化铁反应,在反应后检测生成物.
(4)根据质量守恒定律可得生成的二氧化碳的质量,进而根据反应的化学方程式求算碳酸钙的质量,然后求算杂质的质量分数.
解答 解:(1)“低碳生活”倡导低能量、低消耗,主要是为了减少CO2 (填化学式,不得填写为名称,否则不得分,另外不要受遇到元素名称就说是元素,而不具体考虑)的排放量.
(2)如图1为元素周期表中的一格,对应的是碳元素的有关信息,其原子的核外的电子排布为2,4,所以C是错误的.
(3)利用图2装置可做CO还原Fe2O3实验,并检验该反应生成的气体产物.已知由A装置制取的CO气体中混有少量的CO2.由于一氧化碳中混有二氧化碳,所以要先排除二氧化碳的干扰,而“提示:二氧化碳可以与氢氧化钠溶液反应“,所以可以用氢氧化钠溶液吸收除去二氧化碳.然后一氧化碳和氧化铁反应,生成气体通入到石灰水中检验二氧化碳的生成.本题更准确的方法是A→C(吸收二氧化碳)→B(证明二氧化碳吸收干净)→D→B,但是题目默认装置不能重复使用,意思只要吸收那就吸收干净了.所以是A→CDB.
①CO与Fe2O3反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②气体通过装置的顺序是A→CDB(装置不能重复使用).
③O2与澄清石灰水生成碳酸钙和水,所以CO2与氢氧化钠溶液反应生成碳酸钠和水,对应化学方程式 CO2+2NaOH=Na2CO3+H2O.
④从环保角度考虑,对以上装置的改进措施是 B装置连上集气瓶收集剩余的一氧化碳.
(4)据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
故答案为:(1)CO2;(2)C;
(3)①3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
②CDB;
③CO2+2NaOH=Na2CO3+H2O.
④B装置连上集气瓶收集剩余的一氧化碳.
(4)据质量守恒定律可知,生成的二氧化碳的质量为12.5g+50g-58.1g=4.4g.
设12.5 g 石灰石样品中含CaCO3的质量为x
CaCO 3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4 g
$\frac{100}{44}$=$\frac{x}{4.4g}$
x=10 g
杂质的质量分数=$\frac{12.5g-10g}{12.5g}$×100%=20%
点评 逐一解答每一问,过程注意要严格审题,避免答非所谓.根据化学方程式计算要注意格式的完整性,数据的准确性.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na2CO3--该物质属于氧化物 | |
| B. | 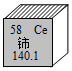 --铈的相对原子质量为140.1g --铈的相对原子质量为140.1g | |
| C. | 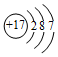 --该原子在反应中易得电子 --该原子在反应中易得电子 | |
| D. | $\stackrel{+2}{Mg}$--“+2”表示镁离子带有两个单位正电荷 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 科学家发现月球的沙土中含有丰富的含氧钛铁矿.若成分为TiO2、Fe2O3的混合物.现用CO进行还原提炼单质钛和铁.实验装置如图所示.按下列要求进行回答:
科学家发现月球的沙土中含有丰富的含氧钛铁矿.若成分为TiO2、Fe2O3的混合物.现用CO进行还原提炼单质钛和铁.实验装置如图所示.按下列要求进行回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com