
分析 本题解得要结合质量守恒定律分析,可以先假设硫酸铜溶液的质量为a,可得反应后生成氢氧化铜的质量为a+4.5g-39.6g.再根据方程式列比例式求解.
解答 解:假设硫酸铜溶液的质量为a,可得反应后生成氢氧化铜的质量为a+4.5g-39.6g=a-35.1g
设参加反应的烧碱质量为X
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 80 98
a×20% X a-35.1g
$\frac{160}{a×20%}$=$\frac{98}{a-35.1g}$
解得:a=40g带入$\frac{160}{a×20%}$=$\frac{80}{X}$
解得:X=4g
答:参加反应的烧碱质量为4g.
点评 解决本题一个重要细节是正确利用质量守恒定律判断生成氢氧化铜质量,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  向等质量的Fe粉和Zn粉中分别加入等质量分数的稀硫酸 | |
| B. |  在混有少量Cu(NO3)2的AgNO3溶液中加入锌粉 | |
| C. |  高温煅烧石灰石 | |
| D. | 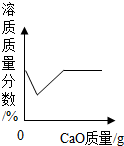 向一定量的饱和氢氧化钙溶液中加少量氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是甲、乙、丙三种物质的溶解度曲线.
如图是甲、乙、丙三种物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是关于初中化学常见的五种物质的转化关系网络(其他反应物和生成物已略去).其中A是黑色固体,B为红棕色固体,C、D、E常温下均为气体,C的相对分子质量大于E.请回答:
如图是关于初中化学常见的五种物质的转化关系网络(其他反应物和生成物已略去).其中A是黑色固体,B为红棕色固体,C、D、E常温下均为气体,C的相对分子质量大于E.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com