
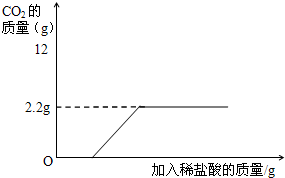
 一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质.化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质.化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作: =
=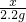
 ×100%=73.5%
×100%=73.5%


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质.化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质.化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com