
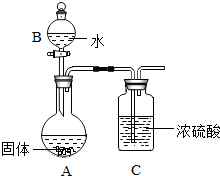
 同学们利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成,甲组同学取一定量燃烧后的固体投入水中.生成碱的同时得到一种能使湿润红色石蕊试纸变蓝的气体,说明固体中含有Mg3N2,生成该气体的化学方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
同学们利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成,甲组同学取一定量燃烧后的固体投入水中.生成碱的同时得到一种能使湿润红色石蕊试纸变蓝的气体,说明固体中含有Mg3N2,生成该气体的化学方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.分析 (1)能使湿润的红色石蕊试纸变蓝色的气体是氨气;氮化镁和水反应生成氢氧化镁和氨气,据此分析方程式;
(2)浓硫酸具有酸性,能吸收碱性气体氨气,氨气易溶于水,加热抑制氨气溶解;
(3)部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;
(4)高温下,MgO和(NH4)2SO4反应生成MgSO4、NH3和H2O,据此书写反应方程式.
解答 解:(1)氮化镁和水反应生成氢氧化镁和氨气,反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
(2)氨气属于碱性气体,浓硫酸具有酸性,所以可以用浓硫酸吸收NH3,则浓硫酸的作用是吸收氨气;
氨气极易溶于水,升高温度抑制氨气溶解,所以加热能将装置A中反应生成的氨气全部驱赶到装置C中,从而减少实验误差;
(3)丙组有的同学认为乙组同学的测定结果偏低,理由是部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;
(4)高温下,MgO和(NH4)2SO4反应生成MgSO4、NH3和H2O,所以该反应方程式为:(NH4)2SO4+MgO$\frac{\underline{\;高温\;}}{\;}$MgSO4+2NH3↑+H2O,从微观的角度说明你能顺利完成该反应的化学方程式的理论依据是反应前后原子的种类和个数不变.
答案:
(1)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(2)吸收氨气;将装置A中反应生成的氨气全部驱赶到装置C中;
(3)部分NH3滞留在装置内没有完全被浓硫酸吸收,从而造成结果偏低;
(4)(NH4)2SO4+MgO$\frac{\underline{\;高温\;}}{\;}$MgSO4+2NH3↑+H2O;反应前后原子的种类和个数不变.
点评 本题考查性质实验方案设计,明确物质的性质及实验原理是解本题关键,难点是误差分析,要根据物质性质结合实验装置分析误差,同时考查学生分析问题的缜密性,题目难度中等.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 水和溶液在生产、生活中起着十分重要的作用,请回答下列问题.
水和溶液在生产、生活中起着十分重要的作用,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 预期实验现象与结论 |
| 步骤2:将步骤1的混合物过滤,取少量滤液于试管中,加入过量的硝酸钡. | 产生了白色, 说明草木灰中含有硫酸钾. |
| 步骤3:将步骤1的混合物过滤,取少量滤液于试管中,加入硝酸银溶液 | 产生了白色沉淀 说明草木灰中含有氯化钾 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com