


分析 (1)化合反应是两种和两种以上物质生成一种物质的反应;
(2)根据反应物和生成物书写化学方程式;可以根据物质的性质和用途及其炼铁原理等方面进行分析、判断,从而得出正确的结论.
(3)Ⅰ、由于装置内空气中的氧气能与碳反应生成二氧化碳,据此分析通入氮气的作用;
根据装置内压强的变化分析反应结束后,熄灭喷灯的火焰后,马上停止通入N2,出现的后果;
根据反应会生成一氧化碳和气体带走一部分水蒸气造成氢氧化钠溶液质量的减少分析;
根据尾气中含有一氧化碳能污染空气分析装置存在的问题.
Ⅱ、氧化铁和盐酸可发生反应,所以剩余后的滤渣是样品中的杂质,从而可计算出矿石中氧化铁的质量分数;
氧化铁和盐酸反应生成氯化铁和水,反应后溶液是氯化铁溶液,反应后溶液中溶质的质量分数的计算,可根据化学方程式求溶质的质量,溶液的质量可根据公式:“反应后溶液的质量=反应前加入的所有物质质量之和-杂质的质量-气体的质量-沉淀的质量”来求出,结合已知量和方程式进行计算即可.
解答 解:(1)化合反应是两种或两种以上物质反应后生成另一种物质的反应;物质和氧发生的化学反应,三个反应都是物质和氧发生的化学反应,故答案为:①;①②③.
(2)根据反应物生成物和质量守恒书写化学方程式为:2CO+4H2$\frac{\underline{\;一定条件\;}}{\;}$CH3OCH3+H2O;合成气为CO和H2 故它们能把铁从铁矿石中还原出来,做还原剂.
(3)Ⅰ、①由题意实验的目的可知,由于装置内空气中的氧气能与碳反应生成二氧化碳,影响实验测定的准确性.所以,通入氮气的作用是:将装置内的空气排尽.
②反应结束后,微粒防止还原出的铁重新被氧化,还需要继续通入氮气.
③由于在高温条件下,碳与氧化铁也会生成一氧化碳,如果氢氧化钠溶液是足量的,对二氧化碳的吸收是完全的,那么甲同学用氢氧化钠溶液的增重测定出氧化铁的质量分数将偏小,其理由:使氢氧化钠增重的质量因一氧化碳的生成和气体带走的水蒸气而偏小;
Ⅱ、氧化铁和盐酸可发生反应,所以剩余后的滤渣是样品中的杂质,赤铁矿石中氧化铁的质量分数为:$\frac{10g-2g}{10g}$×100%=80%
氧化铁的质量是8g,设反应生成氯化铁的质量为x
Fe2O3+6HCl═2FeCl3+3H2O
160 325
8g x
$\frac{160}{325}=\frac{8g}{x}$
x=16.25g
$\frac{16.25g}{(109.5g+8g)}$×100%=13.8%;
答:赤铁矿石中氧化铁的质量分数为80%,反应后溶液中溶质的质量分数约为13.8%;
故答案为:(1)①;①②③;
(2)2CO+4H2$\frac{\underline{\;一定条件\;}}{\;}$CH3OCH3+H2O;将铁从铁矿石中还原出来(或还原剂);
(3)Ⅰ.①将装置内的空气排尽;②不需要断开,还需要继续通入氮气;③偏小,氢氧化钠增重的质量因一氧化碳的生成和气体带走的水蒸气而偏小.
Ⅱ.赤铁矿石中氧化铁的质量分数为80%,反应后溶液中溶质的质量分数约为13.8%.
点评 本题主要考查了实验设计的问题,有关实验方案的设计和对实验方案的评价是中考的热点之一,解答计算时要据物质的性质和方程式细心分析解答.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 宏观变化 | 微观分析 |
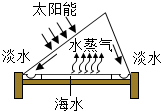 海水淡化示意图 | 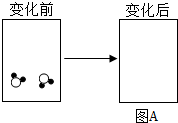 |
 电解水示意图 | 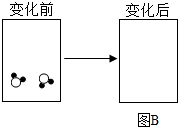 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图,实验台上放置两瓶气体,集气瓶A、B中分别盛有O2、H2中的一种.
如图,实验台上放置两瓶气体,集气瓶A、B中分别盛有O2、H2中的一种.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小明绘制的两种固体物质的溶解度曲线如图所示:
小明绘制的两种固体物质的溶解度曲线如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com