
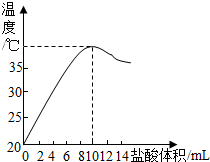
 中和反应是放热反应.取10mL溶质质量分数为10%的NaCl溶液(密度1.10g/mL)置于烧杯中,滴入几滴酚酞,再向烧杯中逐量加入20℃的稀盐酸,随着盐酸加入,烧杯中溶液颜色逐渐变浅,当加入10mL盐酸时,恰好变无色;而且烧杯中溶液温度与加入盐酸体积之间的关系如图所示(已知:HCl+NaCl═NaCl+H2O).
中和反应是放热反应.取10mL溶质质量分数为10%的NaCl溶液(密度1.10g/mL)置于烧杯中,滴入几滴酚酞,再向烧杯中逐量加入20℃的稀盐酸,随着盐酸加入,烧杯中溶液颜色逐渐变浅,当加入10mL盐酸时,恰好变无色;而且烧杯中溶液温度与加入盐酸体积之间的关系如图所示(已知:HCl+NaCl═NaCl+H2O).| 36.5 |
| x |
| 40 |
| 1.1g |
| 1g |
| 10.5g |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
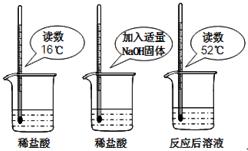 27、氢氧化钠与盐酸发生中和反应的化学方程式为
27、氢氧化钠与盐酸发生中和反应的化学方程式为| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2012?沐川县二模)在一节化学课上,一个精彩的实验探究正在进行:张老师向一支试管中加入氢氧化钠溶液,再逐渐滴加稀盐酸,振荡,使其充分混合.
(2012?沐川县二模)在一节化学课上,一个精彩的实验探究正在进行:张老师向一支试管中加入氢氧化钠溶液,再逐渐滴加稀盐酸,振荡,使其充分混合.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com