
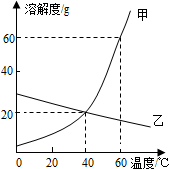
| A. | 50℃时,甲物质的溶解度大于乙物质的溶解度 | |
| B. | 40℃时,甲、乙两物质溶液的溶质质量分数一定相等 | |
| C. | 升高温度可以将乙的饱和溶液转化为不饱和溶液 | |
| D. | 可用100g水配制60℃时溶液质量为180g的甲溶液 |
分析 理解固体溶解度的概念和溶解度曲线的意义,明白固体的溶解度和同温度下饱和溶液中溶质的质量分数间的关系.
解答 解:A.由图示可知,50℃时,甲物质的溶解度大于乙物质的溶解度;正确;
B.40℃时,甲、乙两物质的溶解度相同,故甲、乙饱和溶液的溶质质量分数一定相等;错误;
C.由图示可知,乙的溶解度随温度的升高而减小,因此温度越低,乙的溶解度越大,它的饱和溶液降温才能是变得不饱和;错误;
D.由图示可知,60℃时甲物质的溶解度是60g,故可用100g水在60℃时最多溶解60g甲物质,所得溶液质量为160g的溶液,错误.
故选:A.
点评 主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
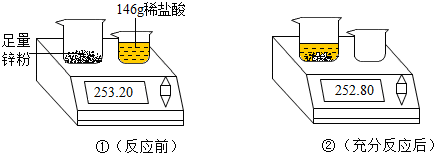
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
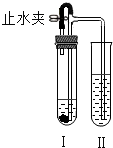 如图所示装置进行实验(图中铁架台等仪器均己略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行实验(图中铁架台等仪器均己略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )| Ⅰ | Ⅱ | |
| A | CaCO3、稀HCl | KNO3 |
| B | Na2CO3、稀H2SO4 | NaCl |
| C | Zn、稀H2SO4 | BaCl2 |
| D | Cu、稀H2SO4 | Ba(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸常用作干燥剂,如湿润的NH3可以用浓硫酸来干燥 | |
| B. | 石灰浆能用来粉刷墙壁是因为石灰浆中的CaO可以和空气中的CO2反应 | |
| C. | 波尔多液是一种农药,可以用铁桶来配制 | |
| D. | 二氧化碳能灭火既利用了其化学性质又利用了其物理性质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将试纸直接浸没在溶液中,测定某溶液的pH | |
| B. | 过滤时,漏斗下端的尖嘴部分需紧贴烧杯内壁 | |
| C. | 未说明药品用量时,一般液体取5毫升左右 | |
| D. | 将氢氧化钠固体放在衬有纸片的托盘上称量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 淀粉溶液中加碘水后溶液变监,说明淀粉与碘的化合物作用生成蓝色物质 | |
| B. | 浓盐酸打开瓶盖后有大量白雾,该白雾就是从浓盐酸中挥发出来的氯化氢 | |
| C. | 水银温度计中的水银柱会随温度升高而升高,说明升温后微粒间距会增大 | |
| D. | 用盐酸浸泡生锈的铁钉后溶液呈黄色,说明反应生成的氯化亚铁是黄色的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体于试管中,加水振荡,直至完全溶解 | 不产生气泡 | 猜想I不成立 |
| ②取少量①的溶液于试管中,滴加CaCl2溶液至过量 | 产生白色沉淀 | 证明有Na2CO3存在 |
| ③取少量②的溶液于试管中,加入 酚酞试液 | 酚酞试液变红色 | 证明有NaOH存在 |
| 综合以上实验现象,说明猜想Ⅱ是成立的. | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com