
将0.5 g某物质在20 ℃时溶于10 g水中即达到饱和,则一般把这种物质的溶解性判定为(? )
A.易溶物质??????? B.可溶物质??????? C.微溶物质??????? D.难溶物质
科目:初中化学 来源: 题型:阅读理解
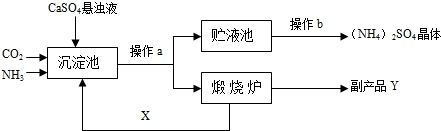
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
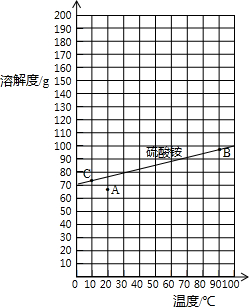
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
| ||
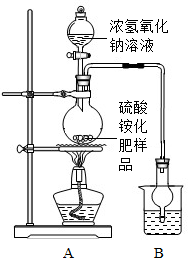
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
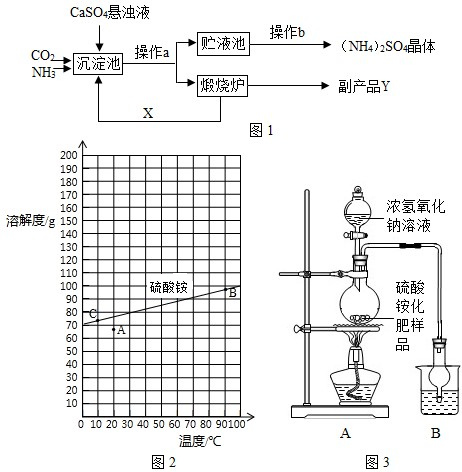
| ||
| ||
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
| 指标 项目 |
优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶, 无可见机械杂质 |
无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |

| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
催化剂在生产、生活和科研中有重要作用。实验室用过氧化氢分解制氧气,常用MnO2作催化剂。
【提出问题】其他物质能代替MnO2作过氧化氢分解的催化剂吗?
【猜 想】甲同学认为CuO或Fe2O3可以代替MnO2,因为按 物质的简单分类MnO2、CuO、 Fe2O3都属于 。
物质的简单分类MnO2、CuO、 Fe2O3都属于 。
【设计实验】甲同 学按下面步骤进行实验:
学按下面步骤进行实验:
①在试管中加入5 mL 5%的过氧化氢溶液,把带火星的木条伸入试管;
②用精密的天平准确称量0.5 g Fe2O3红色粉末,并将其加入另一试管中;
③在步骤②的试管中加入5 mL 5%的过氧化氢溶液,把带火星的木条伸入试管;
④待步骤③的试管中没有气泡后,进行“某一操作”,得到红色固体,将固体洗净、干燥、称量,得红色固体的质量仍为0.5 g。
【现 象】甲同学观察到步骤①中的现象为 ,步骤③中带火星的木条复燃。
【反 思】步骤④中进行的“某一操作 ”是 。乙同学认为在步骤④后必需增加一个实验,请你写出增加这个实验的目的
”是 。乙同学认为在步骤④后必需增加一个实验,请你写出增加这个实验的目的  。
。
【结 论】通过以上实验步骤得出的结论是Fe2O3红色粉末是过氧化氢分解的催化剂 。
。
请根据三氧化二铁的化学式进行计算;(相对原子质量:Fe-56 O-16)
(1)Fe2O3的相对分子质量为 ;
(2)Fe2O3中铁元素和氧元素的质量比为 ;
(3)160gFe2O3中含有 g铁元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com