
分析 (1)根据金属的化学性质,进行分析解答.
(2)Al在高温条件下可以与Fe2O3发生置换反应,写出反应的化学方程式即可.
解答 解:(1)铝能与空气中氧气反应在其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化,因此铝制品抗腐蚀性强.
(2)Al在高温条件下可以与Fe2O3发生置换反应,反应的化学方程式为:2Fe2O3+4Al$\frac{\underline{\;高温\;}}{\;}$4Fe+2Al2O3.
故答案为:(1)铝的化学性质比较活泼,能与空气中氧气反应生成一层致密的氧化铝薄膜;
(2)2Fe2O3+4Al$\frac{\underline{\;高温\;}}{\;}$4Fe+2Al2O3.
点评 本题难度不大,掌握金属的化学性质、化学方程式的书写方法是正确解答本题的关键.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
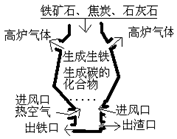 如图所示的炼铁高炉中发生了许多化学反应,其中涉及碳及其化合物的相互转化.请回答下列问题.
如图所示的炼铁高炉中发生了许多化学反应,其中涉及碳及其化合物的相互转化.请回答下列问题.查看答案和解析>>
科目:初中化学 来源:2017届广东省揭阳市揭西县九年级中考模拟化学试卷(解析版) 题型:选择题
向一定溶质质量分数的过氧化氢溶液中加入少量二氧化锰,立即有大量的氧气产生。下列说法正 确的是
A.过氧化氢中含有水和氧气
B.过氧化氢能使二氧化锰分解放出氧气
C.二氧化锰能加快过氧化氢分解生成水和氧气
D.该反应中有过氧化氢和二氧化锰两种反应物,不属于分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 合肥市交通规划的有轨电车即将步入我们的生活,如图为有轨电车的示意图,请回答下列问题.
合肥市交通规划的有轨电车即将步入我们的生活,如图为有轨电车的示意图,请回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验装置 | 实验现象 |
 | 1号试管中无明显现象 |
| 2号试管中无明显现象 | |
| 3号试管中有气泡生成 | |
| 4号试管中有白色沉淀产生 |
| 实验装置 | 实验现象 |
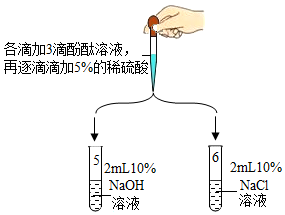 | 5号试管中,滴加酚酞溶液后,溶液由无色变为红色;滴加一定量稀硫酸后,溶液由红色变为无色 |
| 6号试管中始终无明显现象 |
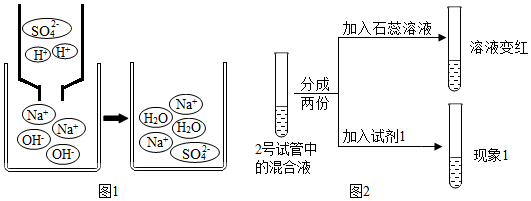
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
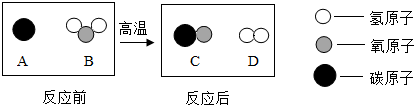
| A. | 反应前后各元素的种类一定不变,各元素的化合价也不改变 | |
| B. | 点燃两种产物前,必须先进行检验防止爆炸 | |
| C. | 该反应不属于四种基本反应类型 | |
| D. | 图示中B、C、D三种物质都是氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com