
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
分析 (一)反应物接触面积越大,反应速率越快;
硫酸钾不能溶解在饱和硫酸钾溶液中;
钡离子能和硫酸根离子结合成白色沉淀硫酸钡,银离子能和氯离子结合成白色沉淀氯化银;
根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
混合溶液中,溶质的溶解度越小,越容易析出晶体;
(二)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
碱石灰中含有氧化钙和氢氧化钠,能够吸收水蒸气和二氧化碳;
根据图中提供的数据可以金属判断G点固体的化学式.
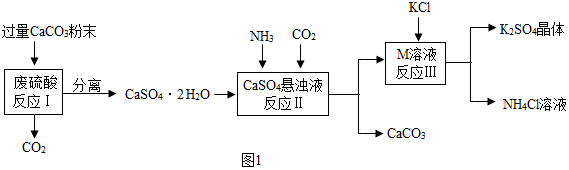
解答 解:(一)(1)将CaCO3研成粉末的目的是增大反应物的接触面积,加快反应速率.
故填:增大反应物的接触面积,加快反应速率.
(2)由上述流程中可知,可循环使用的物质有CO2和CaCO3.
故填:CaCO3.
(3)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是防止K2SO4晶体溶解;
为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,如果不产生沉淀,再向上层清液中滴加AgNO3溶液,如果不产生沉淀,则已经洗的干净.
故填:防止K2SO4晶体溶解;c;a.
(4)反应 II中,硫酸钙和水、氨气、二氧化碳反应生成硫酸铵和碳酸钙,反应的化学方程式为:CaSO4+H2O+2NH3+CO2=(NH4)2SO4+CaCO3↓.
故填:CaSO4+H2O+2NH3+CO2=(NH4)2SO4+CaCO3↓.
(5)由下表相关物质的溶解度可知,反应Ⅲ在常温下能实现的原因是常温下K2SO4的溶解度小.
故填:常温下K2SO4的溶解度小.
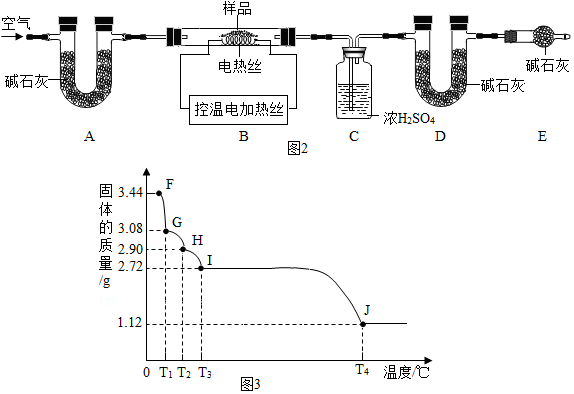
(二)(6)①实验前首先要检查装置的气密性,再装入样品.装置A的作用是除去空气中的CO2和H2O.
故填:检查装置的气密性;除去空气中的CO2和H2O.
②选用b、d数据时,通过D装置可以判断反应生成二氧化碳的质量,进一步可以计算出碳酸钙的质量,通过碳酸钙的质量可以计算分解生成的氧化钙的质量,通过B装置中固体质量减去氧化钙的质量可得硫酸钙的质量,进一步可以计算出CaSO4•2H2O的质量,从而计算CaSO4•2H2O和CaCO3的质量比;
选用c、d数据时,通过D装置可以判断反应生成二氧化碳的质量,进一步可以计算出碳酸钙的质量,通过C装置可以计算CaSO4•2H2O分解生成水的质量,进一步可以计算CaSO4•2H2O和CaCO3的质量比;
求出x:y的值时,若无装置E,空气则水蒸气和二氧化碳会进入D装置,导致计算的二氧化碳质量偏大,从而导致测定结果偏小.
故填:偏小.
(7)设G点固体的化学式为CaSO4•xH2O,
CaSO4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4•xH2O+(2-x)H2O,
172 136+18x
3.44g 3.08g
$\frac{172}{3.44g}$=$\frac{136+18x}{3.08g}$,
x=1,
G点固体的化学式是CaSO4•H2O.
故填:CaSO4•H2O.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源: 题型:填空题
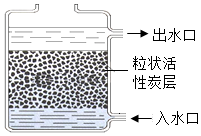 如图所示是一净水器,其中的活性炭具有较强的吸附性,它可以吸附水中的一些可溶性的杂质,并除去异味,粒状的活性炭层还能起到过滤的作用,滤去自然水中的不溶性性杂质.
如图所示是一净水器,其中的活性炭具有较强的吸附性,它可以吸附水中的一些可溶性的杂质,并除去异味,粒状的活性炭层还能起到过滤的作用,滤去自然水中的不溶性性杂质.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
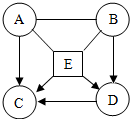 已知A、B、C、D、E均为初中化学常见的酸、碱、盐.其中A为胃酸的主要成分,B是碱,C是生理盐水的组成成分,E在工业上广泛地应用于玻璃、造纸等的生产.将它们配成溶液后,存在如图所示的转化关系,已知A和E能反应产生气体,请回答下列问题(“-”表示相互间能反应,“→”表示在某种条件下能生成该物质):
已知A、B、C、D、E均为初中化学常见的酸、碱、盐.其中A为胃酸的主要成分,B是碱,C是生理盐水的组成成分,E在工业上广泛地应用于玻璃、造纸等的生产.将它们配成溶液后,存在如图所示的转化关系,已知A和E能反应产生气体,请回答下列问题(“-”表示相互间能反应,“→”表示在某种条件下能生成该物质):查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
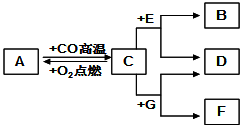 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属.B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属.B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图关系:查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 甲实验可以说明二氧化碳能与NaOH溶液反应 | |
| B. | 乙实验可以粗略测定空气中氧气的含量 | |
| C. | 丙实验可以验证质量守恒定律 | |
| D. | 丁实验可以将CO2中混有的CO全部除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com