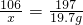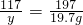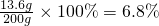将碳酸钠、氯化钠的混合物12.5g完全溶于100g蒸馏水中,再加入向107.2g氯化钡溶液,恰好完全反应后,过滤,洗涤烘干不溶物,称量得其质量为19.7g.计算:
(1)原混合物中氯化钠的质量;
(2)所得溶液中溶质的质量分数(计算结果保留至0.1%).
解:(1)由已知,生成碳酸钡的质量为19.7g
设参加反应的碳酸钠质量为x,生成氯化钠的质量为y.
Na
2CO
3+BaCl
2=BaCO
3↓+2NaCl
106 197 117
x 19.7g y
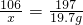
解得x=10.6g
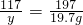
解得y=11.7g
原混合物中氯化钠的质量=15g-10.6g=1.9g
(2)所得溶液中总氯化钠的质量=1.9g+11.7g=13.6g
因此所得溶液的质量=12.5g+100g+107.2g-19.7g=200g
所得溶液中溶质的质量分数=
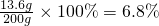
答:(1)原混合物中氯化钠为1.9g;
(2)所得溶液中溶质的质量分数为6.8%.
分析:(1)根据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钡发生反应,碳酸钠与氯化钡生成碳酸钡沉淀和氯化钠,根据生成沉淀碳酸钡的质量可计算样品中所含碳酸钠的质量进而求出原混合物中氯化钠的质量;
(2)恰好完全反应后所得溶液为氯化钠溶液,此时溶液中的溶质氯化钠由原固体中的氯化钠和反应后生成的氯化钠两部分构成,反应后溶液的质量可使用质量守恒定律的方法进行解决,以简化分析.
点评:本道题的第二小题比较难,难点有两个:一是滤液中的溶质氯化钠包括原混合物中的氯化钠和反应生成的氯化钠;二是所得滤液的质量比较难算,不是用溶质的质量+溶剂的质量,而是将所加入的物质的质量全部加起来,再减去生成沉淀的质量.