
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
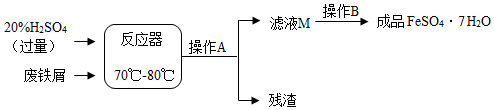
分析 (1)铁和氧化铁都能和稀硫酸反应,可以据此写出反应的化学方程式;
(2)加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁,可以据此解答该题;
(3)操作A为过滤,所以还需要漏斗,可以据此解答该题;
(4)根据图表中的信息可以知道当问到大于64℃时产生了FeSO4•4H2O,可以据此解答该题;
(5)根据四种基本反应类型的特点来解答该题,根据题给的信息可以判断无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁、二氧化硫和三氧化硫,可以据此写出该反应的化学方程式.
解答 解:(1)铁和氧化铁都能和稀硫酸反应生成了硫酸亚铁和氢气,而反应生成了硫酸铁和水,可以据此写出反应的化学方程式;
(2)加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁;
(3)操作A后得到了滤液和固体,所以可以判断操作a为过滤,所以还需要的玻璃仪器为漏斗;
(4)根据图表中的信息可以知道当问到大于64℃时产生了FeSO4•4H2O,所以应该将温度控制在64℃以下;
(5)根据四种基本反应类型的特点可以知道,在置换反应中有单质参与和生成新的单质,所以可以判断在置换反应中一定有化合价的变化,故选B;
2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2+X+7H2O,反应前含有2个Fe原子,2个S原子,15个O原子,14个H原子,反应后含有2个Fe原子,1个S原子,12个O原子,14个H原子,故X中含有1个S原子核3个O原子,是三氧化硫;结合元素化合价的变化可以知道,铁元素的化合价由+2变成了+3价,所以反应中有二氧化硫生成,硫元素的化合价由+6降低到+4,故是氧化还原反应;
故答案为:(1)Fe+H2SO4=FeSO4+H2↑;Fe2O3+3H2SO4═Fe 2(SO4)3+3H2O;
(2)H2SO4、FeS4;
(3)漏斗;
(4)64;
(5)B;SO3;是.
点评 掌握化学方程式的书写、盐的化学性质等知识,并学会分析信息、提取信息,并应用所学知识结合所给信息进行解答,考查了学生分析、解决问题的能力.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某兴趣小组对“蜡烛燃烧的产物”进行探究.
某兴趣小组对“蜡烛燃烧的产物”进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用燃烧的木条鉴别氮气和二氧化碳 | B. | 用肥皂水鉴别硬水和软水 | ||
| C. | 用水鉴别硝酸铵和氢氧化钠固体 | D. | 用稀硫酸鉴别黄铜(Cu、Zn)和黄金 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学兴趣小组根据铁生锈原理,利用还原铁粉、食盐水、活性炭布包,设计如图所示的实验测定空气中氧气的体积分数.
某化学兴趣小组根据铁生锈原理,利用还原铁粉、食盐水、活性炭布包,设计如图所示的实验测定空气中氧气的体积分数.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2O | B. | H2 | C. | Ca(ClO3)2 | D. | HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 自然界中大多数金属以化合物形式存在 | |
| B. | 所有金属的颜色都是银白色 | |
| C. | 黄铜的硬度比纯铜的硬度小 | |
| D. | 生铁可以完全溶解在足量稀盐酸中 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 新津金花梨榨汁 | B. | 温江木雕 | C. | 双流葡萄酿酒 | D. | 都江堰沙里淘金 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com