
| 时间(s) | 天平示数(g) |
| 0 | 362.40 |
| 10 | 362.20 |
| 20 | 362.02 |
| 30 | 361.90 |
| 40 | 361.90 |

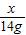 =
=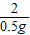
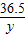 =
=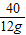
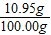 ×100%=10.95%
×100%=10.95%

科目:初中化学 来源: 题型:
 某探究小组的同学对金属的性质很感兴趣,进行了如下探究.
某探究小组的同学对金属的性质很感兴趣,进行了如下探究.查看答案和解析>>
科目:初中化学 来源: 题型:
| 时间(s) | 天平示数(g) |
| 0 | 362.40 |
| 10 | 362.20 |
| 20 | 362.02 |
| 30 | 361.90 |
| 40 | 361.90 |

查看答案和解析>>
科目:初中化学 来源: 题型:
 Ca3(PO4)2 + Fe
Ca3(PO4)2 + Fe H = -283.0 kJ·mol-2
H = -283.0 kJ·mol-2 H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1查看答案和解析>>
科目:初中化学 来源: 题型:解答题
已知某金属M与稀盐酸反应生成H2和MCl2.小智同学利用这一原理来测定金属M的相对原子质量.先称得锥形瓶的质量为148.40g,然后在锥形瓶中加入质量为14.00g的金属M并放在电子天平上,接着将200.00g稀盐酸(过量)迅速注入锥形瓶立即开始记数,有关数据记录如表.回答下列问题:
| 时间(s) | 天平示数(g) |
| 0 | 362.40 |
| 10 | 362.20 |
| 20 | 362.02 |
| 30 | 361.90 |
| 40 | 361.90 |
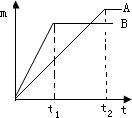
(1)小智实验后对图1下列数据处理的图象正确的是______.
(2)M的相对原子质量是______.
(3)另取上述盐酸100.00g逐滴滴入质量分数为12.00%的NaOH溶液,所用NaOH溶液的质量与溶液的pH变化关系如图2所示.求原盐酸溶液中HCl的质量分数?(精确到0.01%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com