
(2008年泰安市)小明同学在食品包装袋内,发现有一个小纸袋,上面写着“生石灰干燥剂,请勿食用”。他随手将小纸袋拿出来放在桌面上,经过一段较长时间后发现纸袋内的白色颗粒粘在一起成为块状固体M。请你与他一起对块状固体M进行探究。
【探究任务】
(1)探究固体M是否失效;
(2)探究固体M中是否含有氢氧化钙。
【探究方案】

【反思拓展】
(1)你认为“探究二”是否严密 ,其原因是 ;
(2)你认为固体M中除含有氢氧化钙外,还可能含有 ,请你设计实验是否含有该物质 。10.(2008年肇庆市)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为 。
(2)【实验】如下图所示:
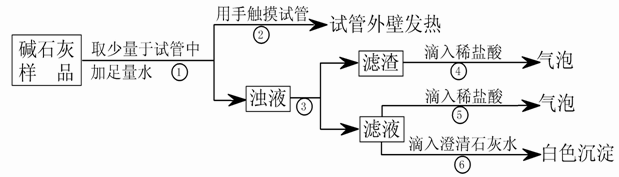
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ (填:成立、不成立)
b.操作④发生化学反应的方程式为 ;由操作⑤⑥的现象判断:滤液中含有 (写化学式);由此判断猜想Ⅰ (填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为 。
(4)【拓展】由上述实验说明,实验室中“碱石灰”应 保存;操作③中玻棒的作用是 。
猜想:(1)氧化钙变质可能发生反应的化学方程式为:CaO+H2O═Ca(OH)2
(3)a.不成立;b.CaCO3+2HCl=CaCl2+CO2↑+H2O;Na2CO3;不成立;c.干燥剂是部分变质,CaO+H2O=Ca(OH)2;2NaOH+CO2═Na2CO3+H2O
【拓展】密封;引流,防止溶液外溅.


科目:初中化学 来源: 题型:阅读理解
(2008年泰安市)小明同学在食品包装袋内,发现有一个小纸袋,上面写着“生石灰干燥剂,请勿食用”。他随手将小纸袋拿出来放在桌面上,经过一段较长时间后发现纸袋内的白色颗粒粘在一起成为块状固体M。请你与他一起对块状固体M进行探究。
【探究任务】
(1)探究固体M是否失效;
(2)探究固体M中是否含有氢氧化钙。
【探究方案】
问题与猜想 | 实验步骤 | 实验现象 | 实验结论 |
探究一:固体M是否失效 | 取适量固体M,加入盛有水的烧杯中,用温度计测量加入前后的温度 | 温度没有明显变化 |
|
探究二:固体M中是否含有氢氧化钙 | 将上述烧杯内的液体充分搅拌、静置,取上层清液,加入无色酚酞试液 |
| 有氢氧化钙 |
【反思拓展】
(1)你认为“探究二”是否严密 ,其原因是 ;
(2)你认为固体M中除含有氢氧化钙外,还可能含有 ,请你设计实验是否含有该物质 。10.(2008年肇庆市)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为 。
(2)【实验】如下图所示:
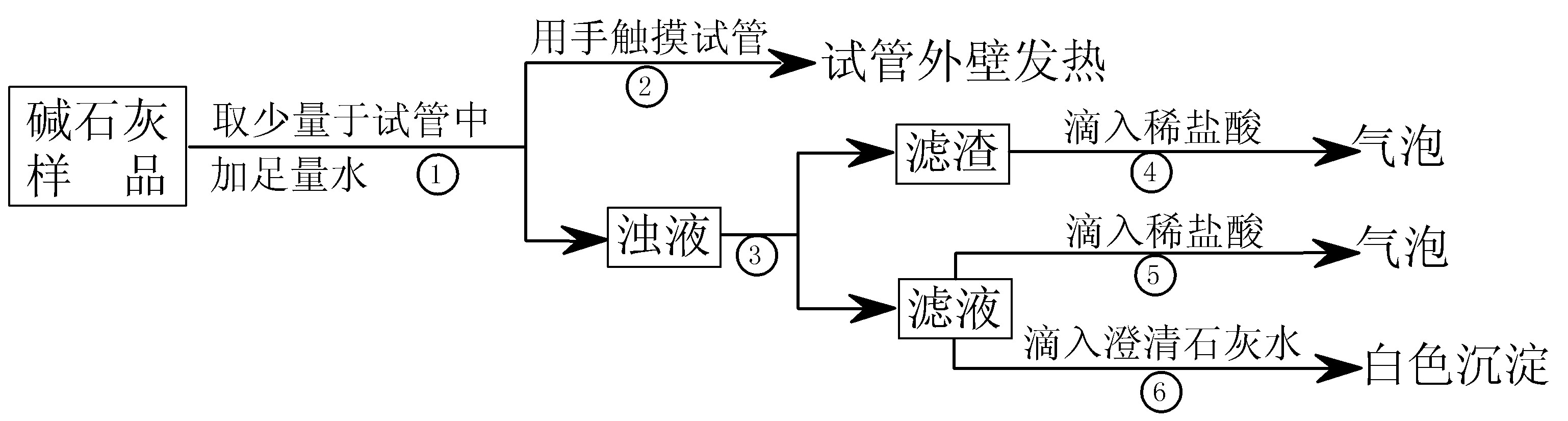
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ (填:成立、不成立)
b.操作④发生化学反应的方程式为 ;由操作⑤⑥的现象判断:滤液中含有 (写化学式);由此判断猜想Ⅰ (填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为 。
(4)【拓展】由上述实验说明,实验室中“碱石灰”应 保存;操作③中玻棒的作用是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
(2008年泰安市)下面的表格中列出了NH4Cl在不同温度下的溶解度:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
(1)由上表可推出溶解度曲线的变化规律是 ;
(2)在20℃时,向100 g水中加入50 gNH4Cl,形成的 (填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,该溶液中溶质与溶剂的质量比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com