
| A. | 碳酸氢钠溶于水后显碱性,所以它是一种碱 | |
| B. | 白醋的pH值小于7,所以它呈酸性 | |
| C. | 某物质在20℃时溶解度是30g,所以在20℃时,溶质为30g的该物质的溶液一定是饱和溶液 | |
| D. | 氧化物是指氧元素与另一种化学元素组成的化合物,所以含有氧元素的化合物都是氧化物 |
分析 A、根据碱、盐的概念进行分析.
B、根据溶液的pH和酸碱性的关系进行分析判断.
C、根据溶解度的概念进行分析判断.
D、根据氧化物的概念进行分析判断.
解答 解:A、碳酸氢钠属于盐,故选项推理错误.
B、白醋的pH值小于7,所以它呈酸性,故选项推理正确.
C、某物质在20℃时溶解度是30g,说明在20℃时,30g该物质溶解在100g水中形成饱和溶液,若溶解在大于100g的水里则是不饱和溶液,故选项推理错误.
D、氧化物是指氧元素与另一种化学元素组成的化合物,但含有氧元素的化合物不都是氧化物,例如氯酸钾,故选项推理错误.
故选:B.
点评 本题难度不大,掌握物质分类的知识、溶解度的概念以及溶液的酸碱性和pH 的关系等是正确解答本题的关键.


科目:初中化学 来源: 题型:填空题
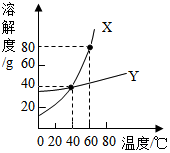 X、Y两种固体物质的溶解度曲线如图所示,回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气罐中的氧气可以供给人呼吸 | B. | 水中氧气的含量为0 | ||
| C. | 氧气被压缩后分子的体积变小了 | D. | 氧气只能以气体的形式存在 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 大力推广使用含磷洗衣粉 | B. | 用未经处理的污水灌溉农田 | ||
| C. | 向河水中倾倒84消毒液杀毒 | D. | 合理使用农药 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金属X可能是钾 | |
| B. | Ag的化学性质比金属X活泼 | |
| C. | 金属X在金属活动性顺序里面一定排在氢后面 | |
| D. | 反应前后,Ag的化合价发生了改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
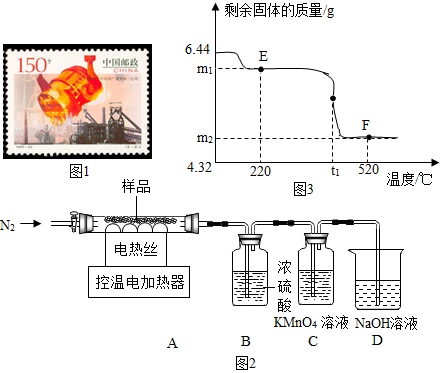
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物 质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 反应后的质量(g) | 12 | 1 | m | 14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com