
分析 锌和稀硫酸反应生成硫酸锌和氢气;
钾、钠、镁比锌活泼,锌比银活泼;
增大浓度、升高温度、增大反应物的接触面积,都能够加快反应速率.
解答 解:(1)稀硫酸与锌反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑.
故填:Zn+H2SO4═ZnSO4+H2↑.
(2)若该同学的猜想是正确的,则在Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4.
故填:Ag2SO4.
(3)要加快上述实验中气体产生的速率,还可采取的措施有加热、增大稀硫酸的浓度等.
故填:加热.
(4)氢气生成速率下降的主要原因是降低了硫酸的浓度.
故填:降低了硫酸的浓度.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:解答题
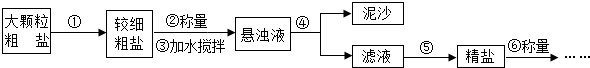
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢气在氧气中燃烧产生大量的白烟 | |
| B. | 向馒头上滴加碘水后变蓝 | |
| C. | 红磷在空气中燃烧发出淡蓝色火焰 | |
| D. | 镁带在空气中燃烧,放出大量的热,生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
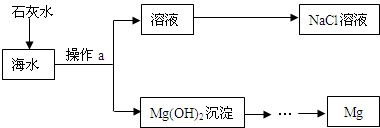
| 实验1 | 实验2 | 实验3 | |
| 海水样品质量/g | 100 | 100 | 100 |
| 加入NaOH溶液质量/g | 10 | 15 | 20 |
| 生成沉淀物的质量/g | 0.22 | 0.29 | 0.29 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
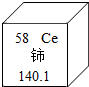 稀土元素是一类有重要用途的资源,铈是一种常见的稀土元素,下列说法中正确的( )
稀土元素是一类有重要用途的资源,铈是一种常见的稀土元素,下列说法中正确的( )| A. | 铈属非金属元素 | B. | 铈的相对原子质量是140.1克 | ||
| C. | 铈原子的质子数为58 | D. | 铈原子中的中子数为58 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁条燃烧:Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | |
| B. | 双氧水中加入少量MnO2:H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ | |
| C. | 高炉炼铁:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| D. | 烧碱溶液滴入硫酸铜溶液中:NaOH+CuSO4=NaSO4+Cu(OH)2↓ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
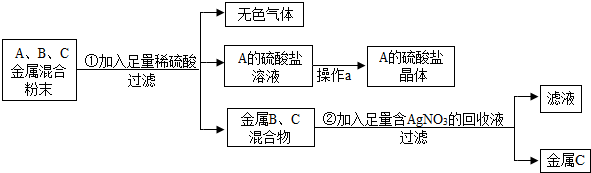
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com