
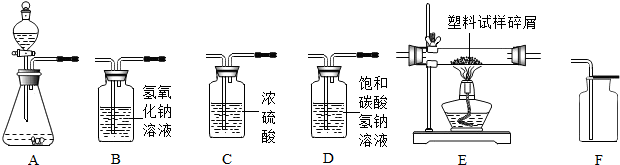
分析 (1)①根据二氧化碳的性质可以知道干燥可以用浓硫酸,而吸收氯化氢气体可以用饱和的碳酸氢钠溶液,可以据此来解答该题;
②根据CO2与NaOH反应生成Na2CO3,Na2CO3溶于水,使溶液的质量增大,判断溶液pH的变化;
(2)①根据以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,产生水和氧气,写出反应的方程式;
②根据“仪器C2质量增加ag,仪器B质量增加bg”,根据二氧化碳的质量可求出二氧化碳中碳元素的质量;
根据水的质量可求水中氢元素的质量;
③根据产生的氧气混有水蒸气,必须干燥,否则将使该塑料试样中氧元素的质量测算结果.
解答 解:(1)①以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳,应该先选择固液反应的A装置作为发生装置,再通碳酸氢钠溶液除去氯化氢杂质,再通过浓硫酸吸水干燥,然后用向上排空气法收集,故连接的顺序为:A→C→B→F;
②CO2与NaOH反应生成Na2CO3,Na2CO3溶于水,使溶液的质量增大,故溶液的质量将增大;
(2)①以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,产生水和氧气,反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②根据“仪器C2质量增加ag,仪器B质量增加bg”,可知:
水的质量为ag,水中氢元素的质量=ag×$(\frac{2}{18}×100%)$=$\frac{a}{9}$;
二氧化碳的质量为bg,二氧化碳中碳元素的质量=bg×$\frac{12}{44}$×100%=$\frac{3b}{11}$g;
故该塑料试样中含氧元素的质量为m-$\frac{a}{9}$-$\frac{3b}{11}$g.
③仪器B1是吸收氧气中的水蒸气,若没有该装置,会使仪器B2增重的质量偏大,即水的质量增加,因此测算出的该塑料试样中氧元素的质量与实际值比较将偏小.
故答案为:
(1)①A→D→C→F;②增大;CO2与NaOH反应生成Na2CO3,Na2CO3溶于水,使溶液的质量增大;
(2)①2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;②m-$\frac{a}{9}$-$\frac{3b}{11}$;③偏小.
点评 本题考查了常见气体的制取、干燥、除杂、收集及反应原理的书写等.综合性较强,在利用氧气的性质测定塑料的组成元素时,要注意区分各步操作的作用和目的,利用质量守恒定律进行相关问题的分析.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源: 题型:选择题
| A. | 化合物是由不同种元素组成的纯净物,所以由不同种元素组成的物质一定是化合物 | |
| B. | 分子、原子都是不带电的粒子,但是不带电的粒子不一定是分子、原子 | |
| C. | 碱溶液一定能使酚酞试剂变红,能使酚酞试剂变红的一定是碱溶液 | |
| D. | 中和反应一定有盐和水生成,所以有盐和水生成的反应一定是中和反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | MgCl2•6H2O | B. | MgCl2•5H2O | C. | MgCl2•3H2O | D. | MgCl2•2H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
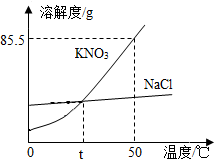 如图为KNO3、NaCl的溶解度曲线.
如图为KNO3、NaCl的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2SO4、NaNO3、NH4Cl | B. | BaCl2、Na2SO4、NaOH | ||
| C. | CaCl2、NaNO3、AgNO3 | D. | FeCl3、CuSO4、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
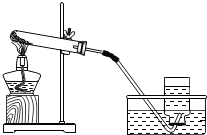
| A. | 实验前应检查装置的气密性 | |
| B. | 试管中加入的药品是MnO2和H2O | |
| C. | 待导管口产生连续均匀的气泡时才开始收集氧气 | |
| D. | 实验结束时应先从水槽中取出导管,再停止加热 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 糯米饭 | B. | 豆腐脑 | C. | 花生糕 | D. | 鸡蛋糕 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com