
复分解反应发生的条件为________.
据此,判断以下各物质间的复分解反应能否发生,能发生反应的,写出相应的化学方程式:
(1)H2SO4+KOH
(2)CaO+HCl
(3)BaCO3+HCl
(4)KOH+NaCl
(5)BaCl2+Na2CO3
(6)CuSO4+KOH
(7)Fe(OH)3+CaCl2
(8)AgCl+H2SO4
科目:初中化学 来源: 题型:阅读理解

| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- 可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- | ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. |
查看答案和解析>>
科目:初中化学 来源: 题型:
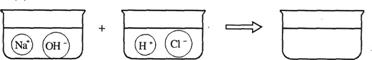
查看答案和解析>>
科目:初中化学 来源: 题型:
| 阴阳 离子 |
OH- | NO3- | Cl- |
| Na+ | 溶 | 溶 | 溶 |
| K+ | 溶 | 溶 | 溶 |
| Ag+ | - | 溶 | 不 |
| H+ | - | 溶 | 溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 阴离子 溶解性 阳离子 |
OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | - | 溶、挥 | 溶、挥 | 溶 | 溶、挥 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | 不 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较. 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较. |
pH>7 | CaCl2、Ca(OH)2 CaCl2、Ca(OH)2 |
pH≤7 pH≤7 |
CaCl2 |
| OH- | Cl- | SO42- | CO32- | |
| H+ | 溶、挥 | 溶 | 溶、挥 | |
| Ba2+ | 溶 | 溶 | 不溶 | 不溶 |
| Ca2+ | 微溶 | 溶 | 微溶 | 不溶 |
| Mg2+ | 不溶 | 溶 | 溶 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com