
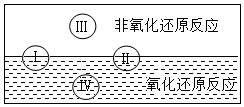
 化学反应中,物质所含元素的化合价发生变化的反应为氧化还原反应.其中化合价升高的发生氧化反应,作还原剂,化合价降低的发生还原反应,作氧化剂.
化学反应中,物质所含元素的化合价发生变化的反应为氧化还原反应.其中化合价升高的发生氧化反应,作还原剂,化合价降低的发生还原反应,作氧化剂.分析 (1)根据氯化铁与铜的反应写出反应的化学方程式,根据化合价的变化分析具有氧化性的物质;
(2)根据化学反应的基本类型与氧化还原反应的关系分析回答;
(3)根据方程式分析元素的化合价的变化,判断是非氧化还原反应的反应;
(4)可以根据物质之间相互作用的情况进行分析、判断,从而得出正确的结论,利用关系:强氧化剂+强还原剂→弱氧化剂+弱还原剂,结合具体的反应对物质或微粒的氧化性或还原性对比分析即可.
解答 解:(1)由题意可知,氯化铁溶液能和单质铜反应生成氯化铜和另一种铁的氯化物,另一种铁的氯化物应是氯化亚铁,该反应的化学方程式可表示为:Cu+2FeCl3=2 FeCl2+CuCl2;由方程式可知,氯化铁中铁元素的化合价由+3价降低变为+2价,是氧化剂具有氧化性;
(2)分解反应有的有化合价的变化是氧化还原反应,有的没有化合价变化的是非氧化还原反应,故Ⅱ为分解反应;复分解反应没有化合价的变化,是非氧化还原反应,故类型Ⅲ为复分解反应,有水生成的复分解反应有很多,例如:碳酸钙与盐酸的反应是复分解反应有水生成,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;置换反应有化合价的变化,属于氧化-还原反应,故反应类型Ⅳ为置换反应,氢气还原氧化铜的反应是有水生成的置换反应,方程式是:H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
(3)①SO3+H2O═H2SO4,没有化合价的变化,是非氧化还原反应;
②Cl2+H2O═HCl+HClO,有单质参加,一定有化合价的变化,是氧化还原反应;
③4Fe(OH)2+O2+2H2O═4Fe(OH)3,有单质参加,一定有化合价的变化,是氧化还原反应;
④SnCl4+2H2O═4HCl+SnO2,没有化合价的变化,是非氧化还原反应;
⑤2Na2O2+2H2O═4NaOH+O2↑、有单质生成,一定有化合价的变化,是氧化还原反应.
(4)A、由2W-+X2→2X-+W2;可知氧化性X2>W2;由2Y-+W2→2W-+Y2可知氧化性W2>Y2;所以氧化性:Y2<X2,故错误.
B、由2W-+X2→2X-+W2;可知还原性W->X-;由2Y-+W2→2W-+Y2;可知还原性Y->W-;由2X-+Z2→2Z-+X2可知还原性X->Z-,所以还原性Y->Z-,故正确.
C、由2W-+X2→2X-+W2;可知还原性W->X-;由2Y-+W2→2W-+Y2;可知还原性Y->W-;由2X-+Z2→2Z-+X2可知还原性X->Z-,所以还原性Y->Z-,所以2Z-+Y2→2Y-+Z2的反应不能够进行,故错误.
D、由2W-+X2→2X-+W2;可知还原性W->X-;由2Y-+W2→2W-+Y2;可知还原性Y->W-;由2X-+Z2→2Z-+X2可知还原性X->Z-,所以还原性顺序是:Y->W->X->Z-,还原性最强的是Y-,故错误.
故答为:(1)Cu+2FeCl3=2FeCl2+CuCl2,FeCl3;(2)分解反应,CaCO3+2HCl=CaCl2+H2O+CO2↑,H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;(3)①④;(4)B.
点评 该题是一道信息给予题,解题的关键是对题干中的原理“强氧化剂+强还原剂→弱还原剂+弱氧化剂”的理解与掌握.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
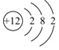 ,镁元素位于周期表中第三周期.;
,镁元素位于周期表中第三周期.;查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | pH为12:BaCl2、Na2CO3、NaOH | B. | pH为1:NaOH、KHCO3、Na2SO4 | ||
| C. | pH为2:KNO3、NaCl、H2SO4 | D. | pH为3:FeCl3、CuSO4、KCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②④ | B. | ④⑥ | C. | ①②④ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com