
 使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.
使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.分析 (1)活泼金属在自然界中以化合物形式存在;
(2)镁在空气中燃烧生成氧化镁;
(3)活泼金属能和空气中的氧气反应生成氧化物;
镁和水反应生成氢氧化镁和氢气;
温度越高,反应速率越快;
钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠;
(4)镁和稀硫酸反应生成硫酸镁和氢气,根据反应的化学方程式和生成氢气的质量可以计算硫酸质量,进一步可以计算所用硫酸溶液中溶质的质量分数.
解答 解:(1)镁比较活泼,镁元素在自然界中是以化合物形式存在.
故填:化合物.
(2)镁能和空气中的氧气反应生成氧化镁,氧化镁的化学式是MgO.
故填:MgO.
(3)①将镁条用砂纸打磨至光亮的原因是除去表面的氧化物.
故填:除去表面的氧化物.
②该反应的化学方程式为:Mg+2H2O=Mg(OH)2↓+H2↑,属于置换反应.
故填:Mg+2H2O=Mg(OH)2↓+H2↑;置换反应.
③步骤2和3对比可知,影响镁与水的反应速率的一个因素是温度,即温度越高,反应速率越快.
故填:温度.
④若将金属钠加到硫酸铜溶液中,钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜和硫酸钠,可能观察到的现象是先产生气泡,后产生蓝色沉淀.
故填:先产生气泡,后产生蓝色沉淀.
(4)设稀硫酸中硫酸质量为x,
Mg+H2SO4═MgSO4+H2↑,
98 2
x 0.4g
$\frac{98}{x}$=$\frac{2}{0.4g}$,
x=19.6g,
所用硫酸溶液中溶质的质量分数为:$\frac{19.6g}{100g}$×100%=19.6%,
答:所用硫酸溶液中溶质的质量分数为19.6%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:解答题
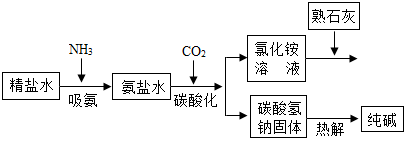 利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德榜先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德榜先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
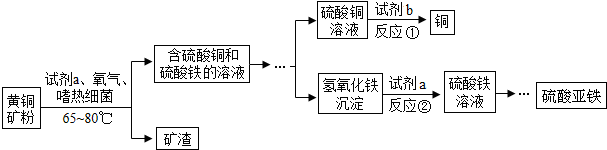
| A. | (1)(2) | B. | (2)(3) | C. | (4)(5) | D. | (2)(5) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
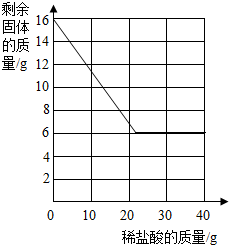 某研究性学习小组的同学前往当地的大理石进行调査,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测.采用了以下的办法:取16g这种大理石,逐滴滴加稀盐酸,剩余固体的质量与所加盐酸的质量关系如图示(杂质不溶于水,不与盐酸反应).
某研究性学习小组的同学前往当地的大理石进行调査,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测.采用了以下的办法:取16g这种大理石,逐滴滴加稀盐酸,剩余固体的质量与所加盐酸的质量关系如图示(杂质不溶于水,不与盐酸反应).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
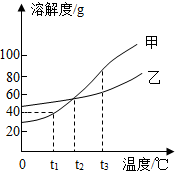 如图所示是甲、乙两种物质(不含结晶水)的溶解度曲线.
如图所示是甲、乙两种物质(不含结晶水)的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
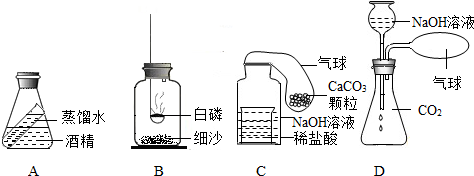
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | 金属R的活动性比Cu强 | ||
| C. | 金属R可能是铝 | D. | 该反应前后R的化合价发生了改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
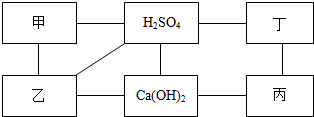 如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.
如图中每条直线两端的物质在一定条件下都可以发生化学反应,其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com