
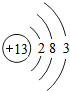 是铝的原子结构示意图.下列说法不正确的是C.
是铝的原子结构示意图.下列说法不正确的是C.
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 取少量固体B, 滴加稀盐酸 | 有气泡 产生 | Zn+2HCl=ZnCl2+H2↑ |
分析 (1)A、根据铝原子的核外电子排布进行分析;
B、根据铝的化合价进行分析;
C、根据铝在地壳中的含量进行分析;
D、根据铝的导电性进行分析.
(2)【交流讨论】根据金属活动性顺序表的应用分析猜想;
【实验探究】根据金属活动性顺序表的应用设计实验探究B的成分;
(3)根据碳的性质分析在炼铁炉中焦炭的作用,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳进行分析;
(4)根据反应的化学方程式结合提供的数据进行分析解答即可.
解答 解:(1)A、原子结构示意图中圆圈内数字就是质子数,所以铝原子质子数是13,故A正确;
B、由于铝原子最外层电子数是3易失去3个电子,显+3价,故B正确;
C、地壳中含量最多的元素是“氧元素”,故C错误;
D、铝做导线就是因为铝具有导电性,故D正确.
故填:C;
(2)【交流讨论】猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银,也就是说只要有硝酸银时,一定也含有硝酸铜;故填:②,Zn应先与AgNO3反应,后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2;
【实验探究】如果猜想①成立说明锌把硝酸银、硝酸铜都反应完了,如果能鉴别出剩余固体中含有锌,就能说明锌过量,铜和银都被它置换出来,由于锌能与酸反应产生氢气,所以向固体中加入盐酸,如果有气体产生,说明锌有剩余;故填:
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 取少量固体B, 滴加 稀盐酸 | 有气泡 产生 | Zn+2HCl=ZnCl2+H2↑ |
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.


科目:初中化学 来源: 题型:实验探究题
 某兴趣小组同学按如图组装仪器进行实验,请回答下列有关问题:
某兴趣小组同学按如图组装仪器进行实验,请回答下列有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| FeCl3溶液 | FeSO4溶液 | |
| 滴入NaOH溶液的现象 | 生成红褐色沉淀 | 先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色沉淀. |
化学方程式 | FeCl3+3NaOH=Fe(OH)3↓+3NaCl 基本反应类型属于 复分解反应反应. | FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 Fe(OH)2+O2+H2O=Fe(OH)3 (用化学式填写空白,不需配平) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用高锰酸钾制氧气,加热时试管的管口应略向下倾斜 | |
| B. | 制备气体前,先装药,然后检查装置的气密性 | |
| C. | 实验结束后,可以用嘴吹灭酒精灯 | |
| D. | 将用剩的药品放回原试剂瓶 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 | 总结 | |
| 实验一 | 取5mL 5%过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,只是反应速率较慢 | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有气泡产生,木条不复燃 | 二氧化锰加入水中,不产生氧气 | |
| 实验三 | 向盛有5mL5%的过氧化氢溶液的试管中,加入二氧化锰,并伸入带火星的木条 | 大量气泡产生,带火星的木条迅速复燃 | 二氧化锰能加快过氧化氢的分解 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
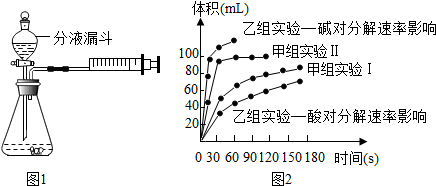
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对过氧化氢分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%过氧化氢 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%过氧化氢 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com