
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
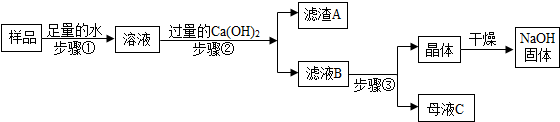
分析 (1)根据表中数据可以获得的信息是:同温下氢氧化钠的溶解度远远大于氢氧化钙的溶解度进行解答;
(2)根据氢氧化钠的溶解度随温度的降低而减小、氧化钙和水反应放热,氢氧化钙的溶解度随温度的升高而增大进行解答;
(3)根据变质的氢氧化钠常会含有碳酸钠,碳酸钠与氢氧化钙反应会生成碳酸钙与氢氧化钠,过量的氢氧化钙会把碳酸钠清除的更干净一些.由氢氧化钠和氢氧化钙的溶解度与温度的关系可确定分离它们的方式.
解答 解:(1)根据表中数据可以获得的信息是:同温下氢氧化钠的溶解度远远大于氢氧化钙的溶解度;故填:同温下氢氧化钠的溶解度远远大于氢氧化钙的溶解度;
(2)氢氧化钠的溶解度随温度的降低而减小,所以把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是:溶液变浑浊;氧化钙和水反应放热,氢氧化钙的溶解度随温度的升高而增大,所以现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质质量分数乙小于甲;故填:溶液变浑浊;<;
(3)(Ⅰ)碳酸钠和氢氧化钙反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,加入过量Ca(OH)2的目的是使碳酸钠完全反应.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;使碳酸钠完全反应.
(Ⅱ)步骤③所包含的具体操作是加热浓缩、降温结晶、过滤.
故填:降温结晶.
点评 了解Ca(OH)2、NaOH溶解度的溶解度随温度的变化情况,并能据所学知识正确分析解答,本题重在考查对知识的掌握和应用.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | |
| 加入氢氧化钠溶液质量 (g) | 35.0 | 40.0 | 45.0 |
| 反应得到沉淀的质量 (g) | 2.5 | 2.9 | 2.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 检验NH4NO3溶液和K2SO4溶液 | NaOH溶液或Ba(NO3)2溶液 |
| B | 除去生石灰中含有杂质石灰石 | 水或稀盐酸 |
| C | 从H2O2溶液制氧气的残余物中分离出MnO2 | 过滤或蒸发 |
| D | 区分失去标签的浓硫酸和稀硫酸 | 水或小木条 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
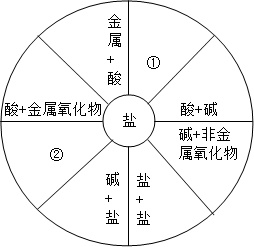 小梅同学学习了单质、氧化物、酸、碱、盐的性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了如图所示的知识网络图.借助网络图回答:
小梅同学学习了单质、氧化物、酸、碱、盐的性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了如图所示的知识网络图.借助网络图回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 环境和食品安全卫生管理,关系百姓身体健康,也是重要的社会民生问题.
环境和食品安全卫生管理,关系百姓身体健康,也是重要的社会民生问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| NaHCO3 | Na2CO3 | |
| 加人稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加人饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加人CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加人过量 的CaCl2溶液. | 有白色沉淀产生 | 该反应的方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液. | 有气泡冒出 | 证明猜想②成立. |
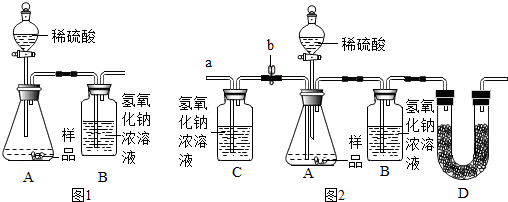
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com