
下列叙述中一定能判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变
B.正、逆反应速率改变
C.混合物中各组分的含量改变
D.混合体系的压强发生改变
科目:初中化学 来源: 题型:
市售过碳酸钠(Na2CO4)中往往含有少量杂质碳酸钠,化学兴趣小组同学购得一包市售过碳酸钠样品,欲测定样品中过碳酸钠的质量分数:
【阅读资料】
①过碳酸钠和盐酸反应的化学方程式为2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
②常温常压下,氧气的密度为1.429g/L
③过碳酸钠通常用作洗衣粉的助剂,可以去除多种顽固污渍,同时清除细菌和异味。
【讨论探究】
甲同学认为可以通过测定反应生成的二氧化碳的体积,求得样品中过碳酸钠的质量分数;乙同学认为可以通过测定反应生成的氧气的体积,求得样品中过碳酸钠的质量分数。兴趣小组经过讨论后,认为甲同学的方案不合理。请你写出可能的原因 ________
_____________________________________________________________________________。
【定量测定】
同学们根据乙同学的实验方案,设计了实验装置(如下图所示),取8.0 g样品投入烧瓶中,逐滴滴加盐酸直至不再产生气泡为止。

(1)装置B的作用是_______________________________________________。
(2)装置C的作用是_______________________________________________。
(3)通过排水量测定氧气的体积为672.0 mL,请计算样品中过碳酸钠的质量分数是多少?
(最后得数保留小数点后一位)
查看答案和解析>>
科目:初中化学 来源: 题型:
已知下列热化学方程式:
①H2(g)+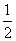 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+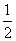 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+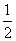 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是__________________________________________。
(2)H2的燃烧热为________;C的燃烧热为________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为________;其热化学方程式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列说法正确的是
( )。
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属最高价氧化物对应水化物的酸性从左到右依次增强
D.第3周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
科目:初中化学 来源: 题型:
部分铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
________________________________________________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的N2
C.升高乙容器的温度
D.增大甲容器的压强
查看答案和解析>>
科目:初中化学 来源: 题型:
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
| 活性炭 | NO(mol) | A(mol) | B(mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)该反应方程式为_______________________________________________________。
(2)在T1 ℃下反应达到平衡后,下列措施能改变NO的转化率的是________(填字母序号)。
a.增大活性炭的量 b.增大压强
c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为____________________________________(生成物A、B用相应的化学式表示)。若T1 ℃时的平衡常数为K1,T2 ℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理由_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
在一密闭烧瓶中,在25 ℃时存在如下平衡:2NO2(g)N2O4(g) ΔH<0,将烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强
⑤密度
A.①和③ B.②和④
C.④和⑤ D.③和⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
甲、乙两种物质的溶解度曲线如下图所示,下列说法中正确的是( )。

A.30 ℃时,50 g水可以溶解25 g甲物质
B.升温能使甲物质的不饱和溶液变为饱和溶液
C.20 ℃时,甲、乙两种物质的溶解度相同
D.30 ℃时,乙物质的溶解度比甲物质的溶解度大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com