
分析 (1)据碳的化学性质分析解答;
(2)据一氧化碳的化学性质分析解答;
(3)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物R的化学式.
解答 解:(1)重要的签字须用碳素墨水笔,这是因为碳单质常温下化学性质稳定,不易与其他物质发生化学反应;
(2)一氧化碳具有还原性,所以冶金工业可利用一氧化碳的还原性来炼铁和其他金属;
(3)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式R+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.反应前氧原子个数为4,反应后的生成物中碳、氢、氧原子个数分别为1、4、4,根据反应前后原子种类、数目不变,则每个R分子由1个碳原子、4个氢原子构成,则物质R的化学式为CH4;
故答案为:(1)化学性质稳定; (2)还原; (3)CH4.
点评 本题难度不大,掌握碳的化学性质、一氧化碳的化学性质、利用化学反应前后原子守恒来确定物质的化学式是正确解答此类题的关键.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:初中化学 来源: 题型:选择题
| A. | 通过电解水的实验,说明水是由两个氢原子和一个氧原子构成 | |
| B. | 过滤是降低天然水硬度的简单方法 | |
| C. | 清澈、透明的矿泉水是纯净物 | |
| D. | 吸附、沉淀、过滤和蒸馏等方法都可以净化水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电解水时,正、负电极上产生气体的体积比为2:1 | |
| B. | 木炭在空气中完全燃烧后生成黑色固体 | |
| C. | 铁在氧气中燃烧生成物为熔融状 | |
| D. | 打开一片浓盐酸,瓶口会出现白色烟雾 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2、CO、C具有可燃性,都可以作燃料 | |
| B. | 生石灰、氢氧化钠溶液都能吸收水分,都能作干燥剂 | |
| C. | 浓盐酸、浓硫酸都应密封存放,否则浓度都会变小 | |
| D. | NH4NO3、NH4Cl分别与Ca(OH)2混合研磨都有NH3放出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 组别 | ① | ② | ③ | ④ |
| 加入物质 | 无 | KMnO4 | MnO2 | Mn |
| 收集到的氧气质量/g | 0 | m1 | m2 | m3 |
| 不溶物的质量/g | 0 | w1 | w2 | w3 |
| A. | 不加入其他物质时,KClO3不能发生分解反应 | |
| B. | KMnO4是KClO3分解制氧气效果最好的催化剂 | |
| C. | 产生氧气的质量关系为m1>m2=m3 | |
| D. | 残留不溶物的质量关系为w1<w2<w3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
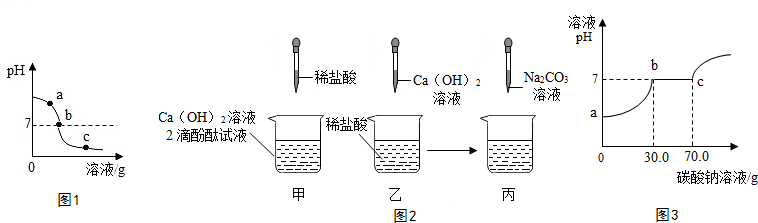
| 实验步骤 | 实验现象 | 实验结论 |
| 另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液. | 只产生白色沉淀 | 该样品为b处溶液. |
| 先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知溶液中的阳离子有Ca2+、H+. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com