
(14分)将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组欲对蓝色固体的成分进行探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;
②Cu(OH)2、CuCO3受热易分解,化学反应方程式分别为:
Cu(OH)2==CuO+H2O CuCO3==CuO+CO2
③无水CuSO4遇水变蓝色。
(三)设计与实验:
Ⅰ.固体的获取:
将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
Ⅱ.用下图所示装置,定性探究固体的成分。
(1)若用装置A、B组合进行实验,B中无现象,则猜想 正确;
(2)若用装置A、C组合进行实验,C中无现象,则猜想 正确;
(3)小组同学将装置按 A、 、 (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的;实验中: C中的现象 。
结论:固体为Cu(OH)2和CuCO3的混合物。
Ⅲ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量变化与分解温度的关系如下图,请根据图示回答下列问题:
(4)根据图示从A点到达B点时的固体质量差,求被分解的氢氧化铜的质量(写出计算过程)。
(5)通过计算可得32.0g固中C元素和H元素的质量比= 。
(6)若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式: 。
(一)Na2CO3+CuSO4="===" CuCO3↓+ Na2SO4 碱
(三)Ⅱ⑴猜想二 ⑵猜想一
⑶ C、B 无水硫酸铜变蓝色
⑷19.6g ⑸ 3:1 (6)4CuO△2Cu2O+O2↑
解析试题分析:(1)根据复分解反应发生的条件,相互交换成分,Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体,发生的化学方程式为:Na2CO3+CuSO4="===" CuCO3↓+ Na2SO4
(2) Na2CO3溶液呈碱性
(三)设计与实验:
(1) 若用装置A、B组合进行实验,B中无现象,说明无二氧化碳生成,则猜想二成立
(2)若用装置A、C组合进行实验,C中无现象,说明无水生成,则猜想一成立
(3)要同时验证生成物中既有二氧化碳生成,又有水生成,应该先验证水,再验证二氧化碳,所以装置应按A、C、B的顺序组合进行实验,这样即可验证出猜想三是正确的,此时C中现象无水硫酸铜变蓝色,B中的澄清石灰水变浑浊,可得出结论:固体为Cu(OH)2和CuCO3的混合物
(4)根据图示从A点到达B点,温度处在200℃以内,此时发生的反应是Cu(OH)2的分解,所以固体质量差是水的质量=32g-28.4g=3.6g,可设氢氧化铜的质量为x
Cu(OH)2==CuO+H2O
98 18
x 3.6g
98:18=x:3.6g ∴x=19.6g
(5)根据上面的计算Cu(OH)2的质量是19.6g,故氢元素的质量=19.6g×2/98×100%=0.4g,CuCO3的的质量=32g-19.6g=12.4g,故碳元素的质量=12.4g×12/124×100%=1.2g,所以32.0g固中C元素和H元素的质量比=1.2g:0.4g=3:1
(6)加热到220℃,此时的Cu(OH)2和CuCO3都已全部分解,得到纯净的CuO24g,若将24.0g剩余固体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,根据质量守恒定律分析,减少的质量只可能是氧气,故此过程中可能发生反应的化学方程式:4CuO△2Cu2O+O2↑
考点:分析说明题,实验探究题的解答


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:探究题
(8分)氢氧化钠与盐酸的反应无明显现象,某化学兴趣小组为证明氢氧化钠与盐酸发生了化学反应,进行了如下的实验探究。
【实验探究一】小云在试管中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液,振荡,溶液变为红色。然后向该试管中滴加稀盐酸,观察到溶液 ,证明氢氧化钠与盐酸发生了反应,该反应的化学方程式为 。
【反思评价】 小霞提出也可以使用石蕊试液代替无色酚酞进行上述实验。你认为 (填“无色酚酞”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
【实验探究二】小兰同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |

查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(18分)工业烧碱(NaOH)具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。某化学学习小组同学围绕工业烧碱展开系列研究。
探究一:工业烧碱中是否含有碳酸钠
【查阅资料】碳酸钠和氯化钙能发生复分解反应。
小红指出可选用下列实验药品来探究:稀盐酸、酚酞试液、CaCl2溶液。
(1)小组同学经过讨论后,一致认为使用 药品不能达到探究目的,理由是 。
(2)请根据选用的实验药品完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量工业烧碱样品配成溶液后,滴加过量 | | 工业烧碱中含有碳酸钠,产生实验现象的化学方程式: 。 |

查看答案和解析>>
科目:初中化学 来源: 题型:探究题
(6分)有一实验事实:铁粉与硫酸铜溶液反应,不但有铜生成,而且有较多的气体产生。为确定气体的成分,进行下列实验探究。
(一)探究:从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种。
(二)实验:
(1)甲同学为确定是否含有SO2,他将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中 SO2(填“有”或“无”)。
(2)乙同学认为只有O2,则可用 来检验。实验证明乙同学的观点不正确
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知:
O2+4KI+4HCl ="==" 2I2+4KCl+2H2O,I2为碘单质。于是他设计了如下的实验装置: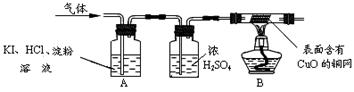
(三)实验现象与结论:A中观察到 ,证明无O2;
B中观察到 ,证明该气体是H2。
(四)实验反思:
(4)大家认为丙同学在加热之前,应对气体先 以确保安全。
(5)由上述实验可知,硫酸铜溶液显 性(填“酸”或“碱”)。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小燕同学在实验室发现一瓶标签破损的无色液体(如图),她根据目前所学的知识,大胆猜想并设计实验进行验证,请你参与她的探究。
提出假设:该无色液体可能是______或___________
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
在实验台上有三瓶未贴标签的溶液,已知分别是碳酸钠溶液、氢氧化钠溶液和稀盐酸。为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如右图所示的探究活动: 
步骤一中,C无明显现象,A、B溶液的颜色变成红色,但A中红色马上褪去恢复为无色。
步骤二中,B溶液的颜色恰好由红色变成无色,且溶液中有气泡冒出;A溶液又变为红色。
下列关于此实验的叙述中正确的是
A. C溶液是氢氧化钠溶液
B. B溶液是稀盐酸
C. 步骤二中实验后B试管中溶质是氯化钠、酚酞
D. 步骤二中实验后A试管中溶质是氯化钠、酚酞
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小明同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡。为了解其反应过程,他与学习小组的同学进行了如下探究。
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验。
要保证实验的效果,实验装置要有良好的气密性,检查A装置气密性的方法是
。
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此同学们得出结论:生成的两种气体分别是 、 (填化学式)。
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究:
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是 ;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
写出上述实验探究中②反应的化学方程式 。
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2 ===CaCO3↓ +2NaCl
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同。
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
| 实验操作 | 主要实验现象 | 结论 |
| ① | | 证明溶液中有Na2CO3 |
| ② | | 证明溶液中既无NaHCO3又无NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小明暑假期间到农田施肥时,发现撒落在地上的碳酸氢铵在阳光的照射下很快消失了,同时有浓烈的刺激性气味。他很好奇,返校后和同学们进行探究,请你一同参与。
【提出问题】温度较高时碳酸氢铵能分解吗?产物是什么?
【猜想假设】碳酸氢铵受热易分解,产物可能为水、二氧化碳、氨气。
【实验设计】小明设计了如图所示的装置进行实验(夹持装置省略)。
(1)根据现象: ,证明实验后生成了水和氨气。
(2)装置B中澄清石灰水 ,证明产物中有二氧化碳生成。
(3)小红同学认为若将装置B中的澄清石灰水改为NaOH溶液,再通过实验验证
B中的产物,也可以证明碳酸氢铵分解后有二氧化碳生成。请你帮她设计并完成验证B中产物的实验。
【实验结论】碳酸氢铵受热易分解,其反应的化学方程式为 。
【实验评价】在上述同学们的探究活动中,你最欣赏的是 。
【实验反思】根据以上实验,你认为碳酸氢铵化肥在存放时应注意的问题是
。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
如图所示,这是一瓶无色无味的气体,根据你已有的知识经验,对它的成分进行探究:
(1)假设:它是一瓶 气体。
(2)设计实验方案证明你的假设:
步骤: ;
现象: ;
结论: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com