
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。CuCl 制备流程如下:
已知:CuCl 难溶于水和乙醇,在潮湿空气中易变质。

(1)“反应”中发生的化学变化是2CuCl2+ Na2SO3= 2CuCl↓+ 2NaCl + SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为________。
(2)“操作 a”的名称是_________。本流程中可以循环利用的物质(水除外)是_________填化学式)。
(3)可用“水洗”的原因是_________,检验水洗是否干净可选用试剂为________(填化 学式)溶液。“醇洗”的目的是_________。
(4)160g CuSO4与足量 NaCl 经上述制备流程,可生成的 CuCl 最多是_________g。
【答案】 SO3 + H2O = H2SO4 过滤 NaCl CuCl难溶于水 AgNO3 快速去除CuCl表面的水分,防止其变质 99.5
【解析】(1)产生的SO3迅速与水化合生成硫酸,该反应的化学方程式为:SO3+H2O═H2SO4;
(3)“操作a”的名称是过滤,通过过滤把液体和固体分离;“反应”中发生的化学变化是 2CuCl2 + Na2SO3 = 2CuCl↓+ 2NaCl + SO3,本流程中可以循环利用的物质(水除外)是NaCl;
(4)CuCl难溶于水,可用“水洗”的原因是能够除去可溶性杂质,水洗主要是除去氯化钠,可以用AgNO3溶液检测水洗是否干净;“醇洗”的目的是可以除去水,防止在后续步骤中CuCl变质;
(5)160gCuSO4中铜元素质量为:160g×![]() ×100%=64g,因为硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多是:64g÷(
×100%=64g,因为硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多是:64g÷(![]() ×100%)=99.5g。
×100%)=99.5g。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源: 题型:
【题目】小红同学向盐酸与氯化钡的混合溶液中逐滴滴入碳酸钠溶液至过量,记录滴入的碳酸钠溶液的质量(x)与有关量的变化关系如图所示,下列判断正确的是

A.①图中,当碳酸钠溶液加至a点时,溶液中Na2CO3正与BaCl2发生反应
B.②图中,当碳酸钠溶液加至b点时,所得溶液的pH=7
C.③图中,当碳酸钠溶液加至c点时,溶液中含有的溶质是氯化钠和氯化钡
D.④图中,当碳酸钠溶液加至d点时,溶液中BaCl2与Na2CO3恰好反应完全
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂,下面是对硫酸的组成、性质、制取、用途等方面的探究,请你共同参与并回答有关问题
探究一、检测硫酸溶液中所含的离子
以下试剂能用来检测硫酸溶液中所含的阴阳离子的组合是____________(填序号)
①石蕊试液 氯化钡溶液 ②PH试纸、硝酸钡溶液 ③石蕊试液 稀盐酸、氯化钡溶液 ④硝酸钡溶液、稀硝酸 ⑤氯化钡溶液稀硝酸
探究二、硫酸的性质
由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异:
(1)探究浓硫酸的某些特征作了如下一些实验:
①用小木棍蘸取少量浓硫酸,放置一会后,可观察到________________
②兴趣小组把98%的浓硫酸10ml和63.3%的硫酸溶液(用10ml98%的浓硫酸与10ml水配成)约20ml分别放入两个相同的小烧杯中,称量、观察、记录、分析;根据室温环境下实验的数据绘成的曲线如图1;
由如图1曲线你能得到的实验结论有哪些?(写两点)_________________________
(2)浓硫酸的稀释;实验室用98%的浓硫酸(密度1.84g/cm3)配制100g溶质质量分数为20%的稀硫酸,需要水的体积为__________ml(精确到0.1);浓硫酸稀释过程如图2所示,b中盛放的物质是__________(填物质名称),a的作用是______________。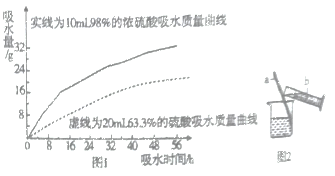
(3)探究稀硫酸的化学性质;
如图选择不同类别的物质与稀硫酸反应发生了如下颜色变化;
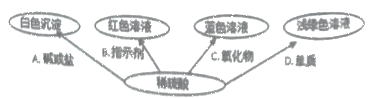
①请在编号C处填一种物质,则C是________________________________(写化学式)
②请写出B体现了稀硫酸的性质是__________________
③请写出符合编号A的一个化学反应方程式__________________
探究三、硫酸的工业制法
工业上黄铁矿为原料生产硫酸的工艺流程如图所示;
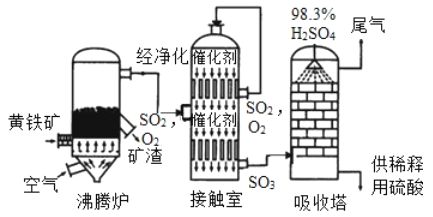
(1)接触室中发生的化学方程式为____________________________________________________ 硫酸是一种重要的化工产品,用途十分广泛,请写出稀硫酸的一种用途_____________________
(2)依据生产硫酸的工艺流程图,下列说法正确的是_____________填字母序号)
为使黄铁矿充分燃烧,需将其粉碎
催化剂能够提高SO2的反应速率和产量
吸收塔中得到的产品为混合物
沸腾炉排除的矿渣可供炼铁
(3)探究某黄铁矿中FeSO2的含量:
同学们进行了如下实验探究(假设每步反应均完全)。
【查阅资料】
①4FeS2+11O2![]() 2Fe2O3+8SO2 ②Na2SO3+H2O2=Na2SO4+H2O
2Fe2O3+8SO2 ②Na2SO3+H2O2=Na2SO4+H2O
【实验探究】
I称取1.60g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应。
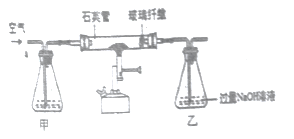
II反应结束后,将乙瓶中的溶液进行如图处理
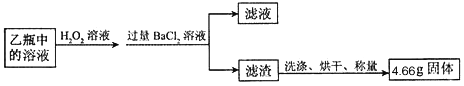
【问题讨论】
①I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是____________________;II中滤液所含的溶质一定有__________________________________。
【含量测定】
②II中最终得到的4.66g固体是_______填物质的化学式);
③计算该黄铁矿中FeS2的质量分数为______________;
【交流反思】
④如果缺少甲装置,则最终测得FeS2的质量分数将会__________________填“偏大”“偏小”“不变”
⑤如何证明II中所加BaCl2溶液已过量(请简要写出操作方法及现象_________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示是KNO3和NaNO3的溶解度曲线。下列说法正确的是
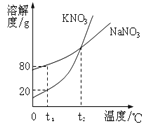
A.t1℃时,两种溶液中溶质质量分数一定不相等
B.t1℃时,在50g水里加入15g KNO3固体,充分溶解,得到60g溶液
C.t1℃时,硝酸钾、硝酸钠两物质饱和溶液升温到t2℃后,溶质质量分数相等
D.两种饱和溶液从t2℃降温到t1℃时,析出晶体:硝酸钾一定多于硝酸钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学学习小组在实验室进行关于气体的实验,所用的部分仪器如图 1 所示。

(1)甲同学选用装置 A 制取氧气,发生反应的方程式是_______,为得到较纯净的氧气 可选择的收集装置是________。
(2)乙同学选用装置 B 加热固体混合物制取氧气,反应方程式是_________。若用装置 F收集氧气,导管口__________(填“a”或“b”)连接发生装置。
(3)丙同学选用图 2 装置制取二氧化碳,与 A 装置相比,它的优点是________。图中所 示的状态表示反应处于________(填“发生”或“停止”)的状态。
(4)实验室常用加热氯化铵与熟石灰固体来制取氨气。常温下 NH3 是一种无色、有刺激 性气味的气体,密度比空气小,极易溶于水,对人体特别是粘膜组织有腐蚀作用。
①写出制取氨气的反应化学方程式__________。
②干燥时不能选用下列干燥剂中的__________。
A.固体氢氧化钠 B.浓硫酸 C.生石灰
③某同学用图 3 的 G、H、I 组合收集氨气。I 装置用于吸收多余的氨气,发生化合反应生成铵盐。写出 I 装置中发生的化学方程式__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】西红柿是营养极为丰富的食物,它含有一种具有重要生理功效的营养素一番茄红素(C40H56).如图是某牌子番茄红素胶囊的说明,请回答:
(1)番茄红素含有____种元素,各元素质量比为____;每个番茄红素分子中含有___个原子核;
(2)若某健康成年人正在通过食用该胶囊来补充番茄红素,则她每天服用的番茄红素质量为____。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】读识下面几种常见元素的原子结构示意图,请写出一种符合要求物质的化学式:

(1)单质____________; (2)氧化物__________;
(3)含有三种元素的酸_____; (4)含有四种元素的盐_________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图为甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
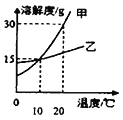
A. 甲、乙两种物质的溶解度都不相等
B. 10℃时,甲、乙两种物质的饱和溶液中,溶质质量分数均为15%
C. 20℃时,甲、乙两种物质的饱和溶液分别降温至10℃,甲析出多
D. 20℃时,将30克乙物质放入100g水中,所得溶液的质量小于130克
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C是初中化学中涉及到的不同单质,它们的相对分子A质量依次增大且不超过65,A 与B,B与C均能发生化学反应,B是水电解的生成物之一。请写出:
(1)A与B反应的现象及化学方程式:__________________,__________________。
(2)B与C反应的现象及化学方程式:_______________,___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com