
| A. | 钙 | B. | 碘 | C. | 锌 | D. | 铁 |
分析 A、根据钙的生理功能和缺乏症进行分析判断.
B、根据碘的生理功能和缺乏症进行分析判断.
C、根据锌的生理功能和缺乏症进行分析判断.
D、根据铁的生理功能和缺乏症进行分析判断.
解答 解:A、钙主要存在于骨胳和牙齿中,使骨和牙齿具有坚硬的结构支架,缺乏幼儿和青少年会患佝偻病,老年人会患骨质疏松,故选项错误.
B、碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大,故选项错误.
C、锌影响人体发育,缺锌会引起食欲不振,生长迟缓,发育不良,易患侏儒症,故选项正确.
D、铁是合成血红蛋白的主要元素,缺乏会患贫血,故选项错误.
故选:C.
点评 化学元素与人体健康的关系是中考考查的热点之一,熟记人体化学元素的分类、生理功能、缺乏症等是正确解答此类题的关键.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:初中化学 来源: 题型:选择题
| A. |  柿子pH=8.5 | B. |  西兰花pH=5.6 | C. |  草莓pH=3.2 | D. |  葡萄pH=2.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
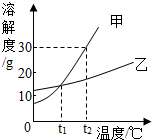 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na、Mg2+、Al3+ | B. | HF、OH -、NH4+ | C. | S、Cl-、Ar | D. | CH4、NH3、H2S |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na+ Cl- OH- | B. | Ag+ Cl- NO3- | ||
| C. | Mg2+ Cl- SO42- | D. | K+ Ca2+ CO32- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 所发生的反应都是置换反应 | |
| B. | 反应后都能生成二氧化碳气体 | |
| C. | 反应后都能生成红色的固体 | |
| D. | 反应前后各元素的化合价都发生了变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 盐酸的质量/g | 25 | 25 | 25 | 25 |
| 烧杯及所盛物质总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com