
如果铁原子的质子数是26,中子是30,那么可以推算:铁原子的核外电子数是________,铁元素的原子序数是________,相对原子量大约是________,这个数大约是一种碳原子的质量的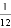 的________倍.
的________倍.
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:初中化学 来源:科粤版九年级上册化学同步测试:1.2《化学实验室之旅》 题型:单选题
下列实验的基本操作中,不正确的是( )
A. 取液后的胶头滴管,平放在桌面上
B. 用滴管滴加液体时,滴管悬空垂直于容器上方
C. 倾倒液体药品时,标签对着手心
D. 用量筒量取液体时,视线与液体凹液面最低处保持水平
A 【解析】 A. 取液后的胶头滴管,应保持橡胶胶帽在上,不要平放或倒置,防止液体倒流,此选项错误;B. 用滴管滴加液体时,滴管悬空垂直于容器上方,以防滴管伸进容器内而被污染,此选项正确;C. 倾倒液体药品时,标签对着手心,防止液体流下来而腐蚀标签,此选项正确;D. 用量筒量取液体时,视线与液体凹液面最低处保持水平,此选项正确。故选A。查看答案和解析>>
科目:初中化学 来源:2019届九年级科粤版化学上册第2章空气物质的构成单元测试卷 题型:简答题
探究原子结构的奥秘.
(情景提供)
(提出问题)电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
(进行实验)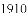
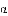
实验做法如图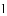
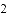
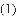
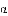
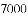
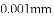
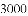
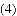
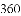
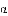
(收集证据)绝大多数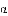
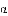
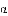
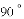 ,有的甚至几乎达到
,有的甚至几乎达到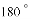 ,像是被金箔弹了回来.
,像是被金箔弹了回来.
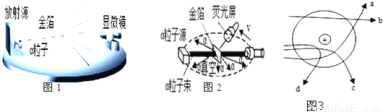
(猜想与假设)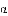
(解释与结论)
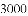
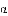
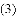
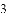
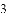
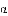
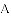
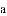
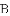
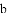
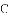
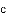
查看答案和解析>>
科目:初中化学 来源:2019届九年级科粤版化学上册第2章空气物质的构成单元测试卷 题型:单选题
一种元素与另一种元素的本质区别是( )
A. 原子质量不同 B. 原子核内质子数不同
C. 核外电子数不同 D. 核内中子数不同
B 【解析】 元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素的种类的是核电荷数(即核内质子数),所以一种元素与另一种元素最本质的区别是核电荷数(即核内质子数)不同。故选B。查看答案和解析>>
科目:初中化学 来源:2018届九年级中考化学专题:原子的有关数量计算练习题 题型:填空题
磷原子核内有15个质子、16个中子,则磷原子核内有________个电子,相对原子质量为________.
15;31 【解析】 磷原子核内有15个质子,原子核外的电子数等于核内质子数,可得:磷原子核外有15个电子;根据相对原子质量≈质子数+中子数,可得:相对原子质量为15+16=31。查看答案和解析>>
科目:初中化学 来源:2018届九年级中考化学专题:原子的有关数量计算练习题 题型:单选题
油条是我国人民早餐的食谱之一,但是在制作油条中,往往加入含有铝元素的明矾,给人健康带来了一定的危害。铝(Al)的原子序数为13,相对原子质量是27。下列有关说法不正确的是
A.铝元素为金属元素 B.铝原子的质量为27g
C.铝原子的核外电子数为13 D.铝原子的中子数为14
B 【解析】 试题在原子中具有质子数=核外电子数=原子序数=核电荷数,原子的质量近似等于质子数+中子数,A选项有最外层的电子数可知是正确的叙述;B选项是错误的叙述,铝原子的相对原子质量是27;C选项是正确的叙述;D选项是正确的叙述 ,故答案选择B查看答案和解析>>
科目:初中化学 来源:2018届九年级中考化学专题:原子的有关数量计算练习题 题型:单选题
最近,“镉大米”成为公众关注的热点问题之一.据了解,含镉的大米对人的肝肾损害比较大.镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( )
A. 镉原子的质子数为48 B. 镉原子的相对原子质量为112g
C. 镉是金属元素 D. 镉原子的核外电子数为48
B 【解析】 试题A、镉(Cd)的原子序数为48,根据在原子中质子数=原子序数可知,镉原子的质子数为48,故此说法正确. B、相对原子质量单位是1,原子质量的单位是g,故此说法错误. C、镉字的偏旁是“金”字旁,故镉是金属元素,故此说法正确. D、镉(Cd)的原子序数为48,根据在原子中原子序数=核外电子数可知,镉原子的核外电子数为48,故此说法正确. 故选B....查看答案和解析>>
科目:初中化学 来源:广东省2019届九年级化学第十一单元测试卷 题型:填空题
食盐是维持人体正常生理活动必不可少的物质。低钠盐能预防高血压,碘盐能补充人体所需碘元素,工业用盐使用不当易使人中毒。
(1)氯化钠中质量分数较大的是__________(填名称)元素。
(2)硫酸镁可以改变钠盐的“口味”,硫酸镁的化学式为_________。
(3)碘盐中加了碘酸钾(KIO3),则KIO3中碘元素的化合价为_________。
(4)工业用盐含NaNO2,NaNO2的名称为_________ (填序号)。
A.磷酸钠 B.硝酸钠 C.亚硝酸钠
氯 MgSO4 +5 C 【解析】(1)根据氯化钠的化学式NaCl及钠元素和氯元素的相对原子质量可知,氯元素的质量分数较大;(2)硫酸镁可以改变钠盐的“口味”,根据化学式的书写原则先读后写,后读先写,可知硫酸镁的化学式为MgSO4;(3)根据化学式中元素的征服化合价的代数和为零计算,钾元素的化合价为+1价氧元素的化合价为-2价,故碘元素的化合价为+5价;(4)工业用盐含NaNO2,NaNO2...查看答案和解析>>
科目:初中化学 来源:湖南省娄底市2018届九年级第二次中考模拟化学试卷 题型:科学探究题
为了解甲酸的分解产物,实验小组进行了以下探究:
【查阅资料】甲酸(HCOOH)的熔点为8.6℃,能分解生成两种物质。
【提出猜想】实验小组对甲酸的分解产物提出了猜想:
猜想1.H2和CO2;猜想2.CO和H2O。
【设计实验】20℃时,甲酸的状态为______;从图一装置中选择合适的装置______(填序号)对甲酸进行加热。为了加快分解速率,实验小组加入了催化剂,反应后将分解产物通入图二装置进行实验。

【实验预测】若猜想l成立,则D中的实验现象应为______。
【进行实验】实验中观察到C处瓶内出现大量水珠,F处玻璃管中出现的现象为______,甲酸分解的化学方程式为______。
【交流拓展】资料表明,不同条件下,甲酸的分解产物不同,猜想1和猜想2均能成立。据此小新对甲酸的分解产物又提出新猜想:猜想3.H2O和CO2;猜想4.CO和H2。经讨论认为无需进行实验就能确定猜想3和猜想4都错误,理由是______。
【设计实验】液态;A;【实验预测】溶液变红;【进行实验】红色物质变成黑色;HCOOHCO+H2O; 【交流拓展】不符合质量守恒定律(反应前后原子数目不相等) 【解析】【设计实验】根据甲酸(HCOOH)的熔点为8.6℃可知,20℃时,甲酸的状态为液态;由于甲酸的状态为液态,故试管应向上倾斜。故应选择装置A; 【实验预测】若猜想l成立,则产物中含有二氧化碳,又D中是紫色石蕊溶液,故D...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com