
分析 根据黄铜的成分铜和锌的性质可知,只有锌与硫酸反应生成了硫酸锌和氢气;林林接着又取少量上述铜粉再加入烧杯中,又产生气泡,说明第一次实验后稀硫酸有剩余,100g含硫酸的废水是混合物,且硫酸有剩余,不能用100g进行计算;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量分数.
解答 解:(1)由质量守恒定律,生成氢气的质量为100g+10g-109.8g=0.2g.
(2)设参加反应的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{2}=\frac{x}{0.2g}$ x=6.5g
这种黄铜的质量分数为$\frac{10g-6.5g}{10g}×$100%=35%.
答:(1)0.2g;(2)这种黄铜的质量分数为35%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:初中化学 来源: 题型:选择题
| A. | NaOH、NaCl、Na2CO3 | B. | Na2CO3、Ba(NO3)2、KOH | ||
| C. | Ba(OH)2、NaNO3、KCl | D. | K2CO3、Ba(NO3)2、BaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | m:2n | B. | 2m:n | C. | m:n | D. | m:3n |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
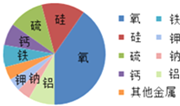 化学语言包括文字语言、符号语言、图表语言等.
化学语言包括文字语言、符号语言、图表语言等.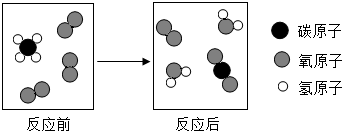
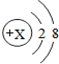 ,则X=11;
,则X=11;查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2O | B. | H2 | C. | O2 | D. | H和O |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com