



 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:初中化学 来源: 题型:
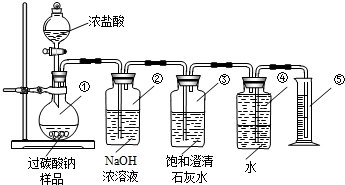
查看答案和解析>>
科目:初中化学 来源: 题型:
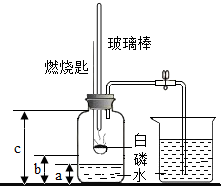 某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.
某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.查看答案和解析>>
科目:初中化学 来源: 题型:
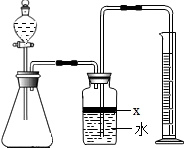 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.查看答案和解析>>
科目:初中化学 来源: 题型:
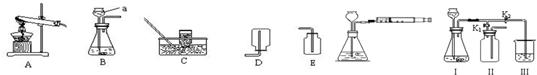
查看答案和解析>>
科目:初中化学 来源: 题型:
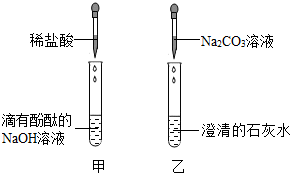
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com