某校化学兴趣小组对金属活动性顺序等知识进行了研究.
(1)根据如图中的实验现象判断,稀盐酸里的A、B、C、D四种金属中,在金属活动性顺序里,位于氢后面的金属是(填字母)
D
D
.

(2)为了确定Fe、Cu、Hg三种金属的活动性顺序,兴趣小组同学用铁片、铜片、硝酸汞溶液和盐酸四种试剂设计了下列实验方案,其中可行的是(
C
C
)
A.Fe+HCl Cu+HCl Fe+Hg(NO
3)
2B.Fe+HCl Fe+Hg(NO
3)
2 Cu+Hg(NO
3)
2C.Fe+HCl Cu+HCl Cu+Hg(NO
3)
2D.Cu+HCl Fe+Hg(NO
3)
2 Cu+Hg(NO
3)
2(3)为了确定铁、铜、银的金属活动性顺序,同学们用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液.实验结束后,化学兴趣小组的同学欲对该实验的废液进行探究,请你一起参与.
[提出问题]废液中含有什么物质?
[交流表达]
①小明通过观察,认为废液中一定含有硫酸铜.他观察到的现象是
溶液显蓝色.
溶液显蓝色.
.
②小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是:
铁和稀硫酸反应生成硫酸亚铁,铁和硫酸铜反应生成硫酸亚铁.
铁和稀硫酸反应生成硫酸亚铁,铁和硫酸铜反应生成硫酸亚铁.
.
[作出猜想]小华认为废液中还可能含有硫酸.
[实验验证]小华同学联想到联想到教材上二氧化碳与水的反应相关实验的设计,准备了abcd四朵用紫色石蕊溶液染成紫色的干燥小花.
取干燥的花a和喷上水的花b分别放入盛满二氧化碳的两个集气瓶中,发现花a不变色,花b成了
红
红
色;
干燥的花c喷水,花不变色,说明了二氧化碳与水反应生成
H2CO3
H2CO3
(填化学式);
在干燥的花d滴加几滴废液,花d变成了
红
红
色,说明废液里含有硫酸.
通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸.
[反思拓展]
①小明取一条铝片加入少量废液中,开始时,铝片表面没有却气泡出现,一段时间后才有气泡出现.开始时,铝片表面没有气泡出现的原因是
铝片表面有一层致密的氧化铝薄膜,能与酸反应
铝片表面有一层致密的氧化铝薄膜,能与酸反应
.
②在分析化学反应后所得的物质成分,除了考虑生成物外还需考虑
剩余的反应物
剩余的反应物
.
[拓展应用1]①若将废液中硫酸铜、硫酸全部转化为硫酸亚铁,应向废液中加入过量的
铁
铁
.②反应完全后,过滤,洗涤、干燥后得到金属固体.
A:实验室进行过滤操作时,用到的玻璃仪器除漏斗、烧杯外,还需
玻璃棒
玻璃棒
.
B:固体中物质为
铜、铁
铜、铁
.
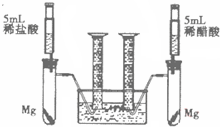
[拓展应用2]为比较同种金属与不同种酸反应的速率,设计了如下实验方案.装置如右图所示(夹持和固定装置已略去).
在两支试管中分别加入过量的镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应的试管中,观察产生氢气的速率和体积.试回答下列问题:
①盐酸与镁反应的化学方程式
Mg+2HCl=MgCl2+H2↑
Mg+2HCl=MgCl2+H2↑
,反应后液体质量(选填“增大”、“减小”、“不变”)
增大
增大
.
②实验中收集到氢气的体积与时间的关系如图所示.分析图中曲线变化规律,可以得出镁与稀盐酸反应速率比与稀醋酸(填“快”或“慢”)
快
快
.
③实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,不可能的原因是(填序号)
.
A.反应放热;
B.试管中有氢气残留;
C.酸液进入试管,占据了一定体积.




 阅读快车系列答案
阅读快车系列答案 某校化学兴趣小组对金属活动性顺序等知识进行了研究.
某校化学兴趣小组对金属活动性顺序等知识进行了研究.

