
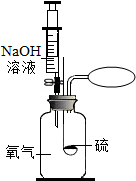
 某同学在做“硫在氧气中燃烧”的实验时,为了防止空气污染,用氢氧化钠溶液 来吸收二氧化硫.下面是该同学实验与计算过程:
某同学在做“硫在氧气中燃烧”的实验时,为了防止空气污染,用氢氧化钠溶液 来吸收二氧化硫.下面是该同学实验与计算过程:分析 (1)据溶质的质量=溶液的质量×溶质的质量分数计算氢氧化钠的质量,并计算溶剂的量,量取一定体积的水用量筒;
(2)据二氧化硫的质量结合方程式计算出反应的氢氧化钠的质量,再结合质量分数的计算式求出氢氧化钠溶液的质量.
解答 解:(1)配制50g溶质质量分数为5%的氢氧化钠溶液.用天平称取氢氧化钠的质量是:50g×5%=2.5g,则需要 水的质量是50g-2.5g=47.5g,水的密度为1g/cm3,合47.5mL,用50mL量筒量取;
(2)设吸取氢氧化钠的质量 是x
SO2+2NaOH=Na2SO3+H2O
64 80
0.32g x
$\frac{64}{80}$=$\frac{0.32g}{x}$
x=0.4g
则吸取氢氧化钠溶液的质量为0.4g÷5%=8g
故答案为:(1)2.5;50mL量筒;47.5;
(2)针筒要 吸取氢氧化钠溶液的质量为8g.
点评 明确溶质的质量分数,及方程式计算的方法,才能结合题意正确解答.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | N60是一种新型的化合物 | B. | 一个N60分子中含有30个N2分子 | ||
| C. | N60和N2混合后形成的是混合物 | D. | N60和N2的性质完全相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 生成气体的质量为0.4g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 反应中消耗硫酸质量为10.78g | |
| D. | 原混合物中铜元素的质量不一定为0.64g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某同学在实验室发现一瓶标签残缺(如图1所示)的溶液.为了测定此溶液的溶质质量分数,他取出10g该溶液,向其中逐滴加入溶质质量分数为20%的NaOH溶液.反应过程中溶液的pH与所用NaOH溶液质量的关系如图2所示.
某同学在实验室发现一瓶标签残缺(如图1所示)的溶液.为了测定此溶液的溶质质量分数,他取出10g该溶液,向其中逐滴加入溶质质量分数为20%的NaOH溶液.反应过程中溶液的pH与所用NaOH溶液质量的关系如图2所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Cu | B. | CuO | C. | Cu2O | D. | CuOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com