



科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
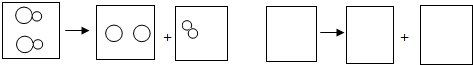
 (2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.
(2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.| 实验操作 | 实验现象 |
| (1)取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| (2)静置一段时间后,倾去上层清液,向沉淀中继续滴加稀盐酸 | 白色沉淀全部溶解,产生大量气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 指示剂 (花汁) |
在不同溶液中的颜色变化 | |||
| 盐酸 | 酒精溶液 | 氢氧化钠溶液 | 石灰水 | |
| 红玫瑰 | 粉红色 | 粉红色 | 绿色 | 绿色 |
| 万寿菊 | 黄色 | 黄色 | 黄色 | 黄色 |
| 月季花 | 浅红色 | 红色 | 黄色 | 黄色 |
查看答案和解析>>
科目:初中化学 来源: 题型:
“侯氏制碱法“制得的炖碱(Na2CO3)中常含有少量氯化钠,某化学兴趣小
组的同学拟侧定某纯碱样品中Na2CO3的质量分数。
【方案一】沉淀分析法(如下图所示)

则:
(1)"操作I.的名称是 。
(2)溶液M中含有的阳离子有 。
(3)确定CaCl2溶液是否过量的方法是 。
A 静置混合物,向上层溶液中再滴加CaCl2溶液,如果无沉淀,则过量
B 向落液M中滴加CaCl2溶液,如果有沉淀,则过量
(4)若沉淀A^没有洗涤、烘干,导致Na2CO3的质量分数 (填“偏大”“偏小”“不变”).判断沉淀A洗净的方法是:取最后一次洗涤所得滤液,滴加AgNO3溶液,若 (填“有”或“无”)白色沉淀,则洗涤干净.
(5)样品中Na2CO3的质量分数为 (用字母m ,n的代数式表示)。
【方案二】气体分析法

(1)A装置中反应的化学方程式为 ,盛放稀硫酸的仪器名称为
(2)B装置的作用是 C装置中反应的化学方程式为
(3)通过称 装置中反应前后的质量,即可求得产生二氧化碳的质量。
(4)理论上【方案二】比【方案一】会产生较大的误差,原因是 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com