
科目:初中化学 来源: 题型:实验探究题
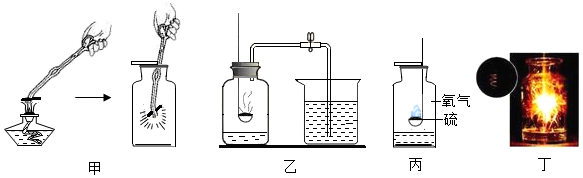
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 第1次 | 第2次 | 第3次 | |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
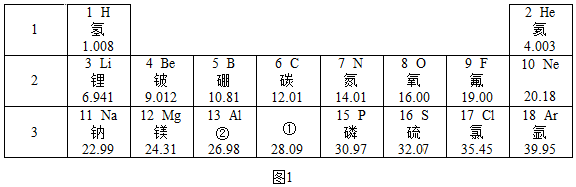
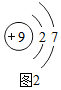 (2)图2为氟原子结构示意图,氟原子在化学反应中得到(填“得到”或“失去”)电子的能量最强,氟气和氢气在阴暗条件下就能迅速反应而爆炸,由此请你提出一条存放氟气的注意事项避免与氢气混放.
(2)图2为氟原子结构示意图,氟原子在化学反应中得到(填“得到”或“失去”)电子的能量最强,氟气和氢气在阴暗条件下就能迅速反应而爆炸,由此请你提出一条存放氟气的注意事项避免与氢气混放.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
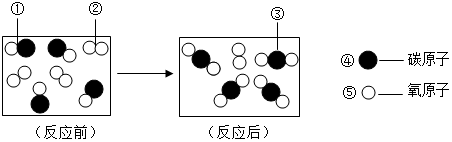
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com