
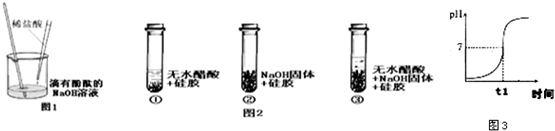


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:初中化学 来源: 题型:
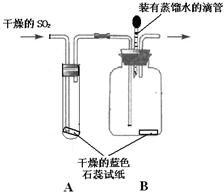 14、某研究性学习小组对“SO2能否与H2O反应生成酸”的课题开展探究.查阅资料后得知:
14、某研究性学习小组对“SO2能否与H2O反应生成酸”的课题开展探究.查阅资料后得知:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 | |
| ① | 取少量滤液, 滴入纯碱溶液 |
没有白色沉淀产生 | 滤液中不含Ca(OH)2 滤液中不含Ca(OH)2 |
| ② | 另取少量滤液, 滴入酚酞溶液 |
溶液变红色 溶液变红色 |
含有氢氧化钠 |
| ③ | 再取少量滤液, 滴入澄清石灰水. |
有白色沉淀产生 有白色沉淀产生 |
含有碳酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 二氧化锰 |
| 二氧化锰 |
| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com