
 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑; K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑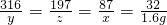
 K2MnO4+MnO2+O2↑;(2)高锰酸钾分解后产生氧气的质量是1.6g;(3)剩余固体中含有高锰酸钾、锰酸钾和二氧化锰,质量分别是0.2g、9.85g、4.35g;
K2MnO4+MnO2+O2↑;(2)高锰酸钾分解后产生氧气的质量是1.6g;(3)剩余固体中含有高锰酸钾、锰酸钾和二氧化锰,质量分别是0.2g、9.85g、4.35g;

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
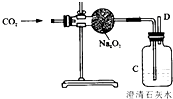 “嫦娥三号”飞船的成功发射是我国航天事业的又一里程碑.金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气和碳酸钠;为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.
“嫦娥三号”飞船的成功发射是我国航天事业的又一里程碑.金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气和碳酸钠;为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com