
 在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).
在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).
分析 (1)根据物质的腐蚀性以及物质的检验方法来分析;
(2)根据铁生锈的条件进行分析解答本题;
(3)根据生石灰的性质以及影响气体溶解度的因素来分析;
(4)根据明矾的净水原理、质量守恒定律、影响反应速率的因素以及反应特点来分析.
解答 解:(1)氢氧化钠、浓硫酸具有很强的腐蚀性,日常生活中很少用它作除湿剂;氢氧化钠极易和空气中的二氧化碳反应生成碳酸钠和水而变质,在实验室检验碳酸盐的存在常向样品中加盐酸,因为碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,故看是否会生成气体而进行检验.故填:腐蚀性强,稀盐酸(合理即可);
(2)铁在潮湿的环境中容易和水分及氧气反应而生锈,故铁粉能够吸收空气中的水分和氧气,常用于食品保鲜.故填:氧气和水蒸气;
(3)生石灰与水反应生成氢氧化钙,此过程中会放出大量的热,造成可乐的温度升高,而气体的溶解度随着温度的升高而减小,所以导管口有气泡冒出,生成的二氧化碳与水反应生成碳酸,碳酸显酸性能使紫色的石蕊试液变红色;故填:有气泡,石蕊变红;变小;CO2+H2O=H2CO3;
(4)a.明矾是一种常用的净水剂,废水中加入明矾后,会吸附悬浮物,使其沉降;故填:吸附悬浮物,使其沉降;
b.由质量守恒定律可知,反应前后,原子的种类和数目不变,反应前有:2C、6H、Cu、2O;反应后有:2C、4H、O、Cu,所以空格处填写的化学式为H2O;故填:H2O;
c.增大反应物的浓度,升高温度或将固体反应物研磨成粉末状增大了反应物之间的接触面积,这样都会加快化学反应的速率;故填:增大氢氧化钠溶液的浓度或将固体粉碎或升高温度等;
d.由流程图可知,硅胶可再生、没有腐蚀性;而氧化钙与水反应会放出大量的热而造成伤害;故填:可再生、无腐蚀性,氧化钙与水放热易造成伤害.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:解答题
 乙醇汽油作为一种新型清洁燃料,符合我国能源替代战略和可再生能源发展方向,技术上成熟安全可靠,在我国完全适用,具有较好的经济效益和社会效益,请回答以下有关的问题
乙醇汽油作为一种新型清洁燃料,符合我国能源替代战略和可再生能源发展方向,技术上成熟安全可靠,在我国完全适用,具有较好的经济效益和社会效益,请回答以下有关的问题查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 实行垃圾分类回收再利用 | B. | 控制烟花爆竹的燃放 | ||
| C. | 推广秸秆综合利用杜绝露天焚烧 | D. | 过量使用农药化肥提高农作物产量 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
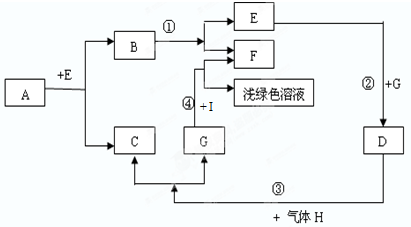
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
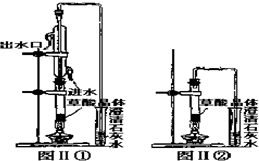 小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.
小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.| 实验步骤 | 实验现象 | 实验结论 |
| ①将菠菜在少量开水中煮沸2min~3min,取1mL~2mL滤液于试管中,丙滴加少量CaSO4或CaCl2溶液 | 产生白色沉淀 | 有草酸钙生成 |
| ②在步骤①的沉淀物中加入过量稀盐酸 | 沉淀部分溶解且产生气泡 | 被溶解的沉淀一定不是CaC2O4 |
| 实验步骤 | 实验现象 | 实验结论 |
| ③将步骤②产生的气体通入澄清的石灰水中 | 澄清的石灰水变浑浊 | 产生的气体是CO2步骤②被溶解的沉淀是碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 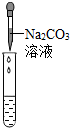 | 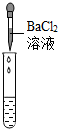 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
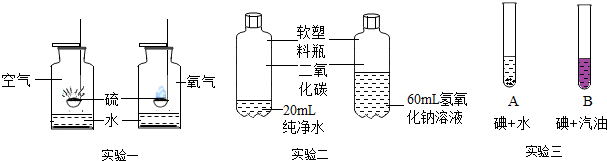
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
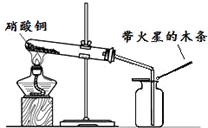 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.
硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过 滤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验 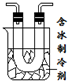 | 集气瓶中气体为无色,带火星的木条复燃 带火星的木条复燃 | 硝酸铜分解生成了氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 凉拌黄瓜 | B. | 清蒸螃蟹 | C. | 玉米窝头 | D. | 红烧肥肉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com