
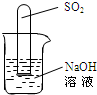
 用大棚种植蔬菜时,常向大棚中补充气体肥料CO2.若提供的气体肥料CO2中混有少量的SO2,为了除去SO2,现设计以下两种方法.
用大棚种植蔬菜时,常向大棚中补充气体肥料CO2.若提供的气体肥料CO2中混有少量的SO2,为了除去SO2,现设计以下两种方法.分析 要除去CO2中的SO2就要根据这两种物质的性质,它们都属于酸性氧化物,酸性氧化物能与碱溶液反应,所以不能用氢氧化钠溶液除CO2中的SO2,只能选用能与SO2反应,但不能与CO2反应的aHCO3.另外,要仔细阅读所提供的资料,挖掘有用的信息来解决题目中的问题.
解答 解:(1)除去CO2中的SO2不能将气体通过足量的氢氧化钠溶液的原因是CO2能和氢氧化钠溶液反应,故答案为:甲,CO2与NaHCO3不会发生反应,但能与氢氧化钠溶液反应;
(2)按如图所示的装置进行实验,发现试管内液面上升,可能是CO2与NaOH溶液反应的结果所以此结论不严谨,故答案为:SO2与CO2都与NaOH溶液反应.
(3)要证明SO2与NaOH溶液反应,根据提供的资料,可以验证生成物,故答案为:倒扣试管后,在原NaOH溶液中滴入2滴紫色高锰酸钾溶液,红色慢慢变浅.
点评 解答本题要充分理解各种物质的性质方面的知识,学会利用资料,结合已有知识解决问题,只有这样才能对相关方面的问题做出准确的判断.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水在生产和生活中起着十分重要的作用.
水在生产和生活中起着十分重要的作用.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只含有碳、氢、氧元素 | |
| B. | 一定含有碳、氢、铜元素,可能含有氧元素 | |
| C. | 一定含有碳、氢、氧元素,可能含有铜元素 | |
| D. | 肯定含有碳、氢、氧、铜四种元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 已知M,N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.
已知M,N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.| 实验步骤 | 实验现象 | 结论 |
| 取少量该溶液,向其中滴加紫色石蕊溶液 | 溶液变红色 | 为c处溶液,并推知溶液中的阳离子有 Na+、H+、SO42(填离子符号) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
①取少量样品溶于水,加入过量的氯化钙溶液 | 有白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合物过滤,取滤液,加入酚酞试液 | 溶液变红色 | 证明猜想Ⅱ正确 |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com