
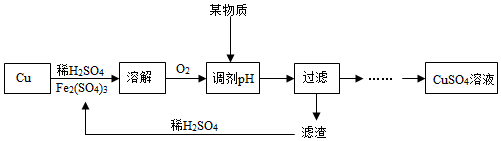
分析 (1)不同的实验方案,优缺点不同;
(2)空气中二氧化硫含量过高时,会导致产生酸雨;
(3)氢氧化铁和稀硫酸反应生成硫酸铁和水;
(4)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式.
解答 解:(1)方案二与方案一相比,优点是实验的操作步骤不需要走分步进行和不需要加热;
但工业上不采用方案二大量使用H2O2制硫酸铜的原因是:需要消耗大量的过氧化氢,成本高.
故填:不需要加热;成本高.
(2)方案三与方案一、二相比,缺点是生成相同质量硫酸铜时消耗硫酸多和反应会产生SO2;
生产生活中大量的SO2排放到空气中时,二氧化硫能和水反应生成亚硫酸、硫酸等物质,容易形成酸雨.
故填:生成相同质量硫酸铜时消耗硫酸多;酸雨.
(3)②溶液中pH=3.2时Fe(OH)3开始沉淀,实验流程中“滤渣”是氢氧化铁,氢氧化铁的化学式为Fe(OH)3;
氢氧化铁与稀H2SO4反应生成硫酸铁和水,反应的化学方程式为;2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O.
故填:Fe(OH)3;2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O.
(4)NO2溶于H2O时生成HNO3和NO,反应的化学方程式为:3NO2+H2O=2HNO3+NO;
若采用方案五制取CuSO4溶液,根据上述查阅资料所获得的反应原理,改进的实验方案中可循环使用的物质是NO2.
故填:3NO2+H2O=2HNO3+NO;NO2.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:计算题
| 加入的稀盐酸(g) | 20 | 40 | 60 |
| 生成气体的质量(g) | 2.2 | 4.4 | 4.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 流程中CaCO3可循环使用 | |
| B. | 将CaCO3研成粉末的目的使反应更充分 | |
| C. | M和碱混合微热产生无色无味气体 | |
| D. | 洗涤所得晶体,是为了除去表面的杂质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
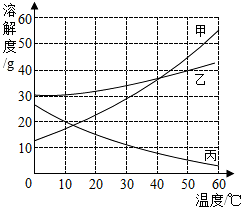 甲、乙、丙三种固体物质的溶解度曲线如图所示.请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
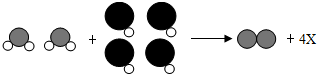
| A. | 该反应为置换反应 | |
| B. | 参加反应的分子个数比为1:2 | |
| C. | 有元素的化合价在反应前后发生变化 | |
| D. | 一个X分子中含有三个原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示,甲、乙、丙三种物质的溶解度曲线,请回答下列问题:
如图所示,甲、乙、丙三种物质的溶解度曲线,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该物质不属于有机化合物 | |
| B. | 阿昔洛韦中碳元素的质量分数为$\frac{12×8}{12×8+11×1+14×5+16×3}$×100% | |
| C. | 阿昔洛韦中 C、H、N、O 三种元素的质量比为8:11:5:3 | |
| D. | 阿昔洛韦是由8个碳原子,11个氢原子,5个氮原子,3个氧原子构成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com