
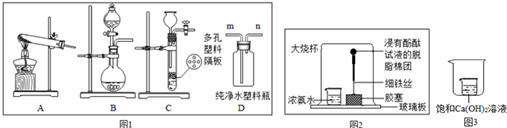
分析 制取装置包括加热和不需加热两种,加热熟石灰和氯化铵固体混合物可以生成氨气,因此需要加热;若要快速产生氨气,可以将浓氨水滴加到生石灰中得到,就不需要加热,分液漏斗可以控制反应的速度;用D装置收集氨气,判断氨气已经收集满的方法是:把湿润的红色石蕊试纸放在m管口处,红色变蓝色,证明氨气已经满了;如图2所示的装置探究氨的性质,观察到脱脂棉团由白色变为红色,该现象涉及到的性质是:氨分子是不断运动的,浓氨水具有挥发性,氨气的水溶液显碱性;如图3,观察到小烧杯中饱和溶液变浑浊,说明加入的物质放出热量,温度升高,因此是水和浓硫酸、水和氢氧化钠固体,熟石灰的溶解度随温度的升高而减小.
解答 解:(1)加热熟石灰和氯化铵固体混合物可以生成氨气和水和氯化钙,配平即可,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)若要快速产生氨气,可以将浓氨水滴加到生石灰中得到,就不需要加热,分液漏斗可以控制反应的速度;故答案为:B;
(3)用D装置收集氨气,判断氨气已经收集满的方法是:把湿润的红色石蕊试纸放在m管口处,红色变蓝色,证明氨气已经满了;故答案为:把湿润的红色石蕊试纸放在m管口处,红色变蓝色,证明氨气已经满了;
(4)如图2所示的装置探究氨的性质,观察到脱脂棉团由白色变为红色,该现象涉及到的性质是:氨分子是不断运动的,浓氨水具有挥发性,氨气的水溶液显碱性;故答案为:ABD;
(5)如图3,观察到小烧杯中饱和溶液变浑浊,说明加入的物质放出热量,温度升高,因此是水和浓硫酸、水和氢氧化钠固体,熟石灰的溶解度随温度的升高而减小故答案为:AD;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、氨水的性质、物质溶解时的吸热和放热现象等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


科目:初中化学 来源: 题型:填空题
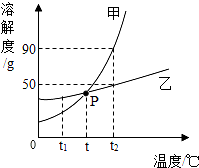 如图为甲、乙两种物质的溶解度曲线,据图回答下列问题.
如图为甲、乙两种物质的溶解度曲线,据图回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 用科学方法认识和改造物质
用科学方法认识和改造物质查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,加适量水,搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 | ①滤液不变色 ②有气泡产生 | 氢氧化钙全部变为碳酸钙 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,加适量水,搅拌,过滤 ①取少量滤液于试管中,滴入酚酞试液 ②取少量滤渣于试管中,加入盐酸 | ①酚酞试液变红色 ②产生气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 降低饱和溶液的温度,一定有晶体析出 | |
| B. | 长期放置后不会分层的液体不一定是溶液 | |
| C. | 硝酸钾饱和溶液一定比其不饱和溶液质量分数大 | |
| D. | 配制好6%的NaCl溶液,装瓶时不小心撒漏一部分,瓶中NaCl溶液浓度小于6% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com