
(3分)为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,阳阳同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
|
|
第一次 |
第二次 |
第三次 |
第四次 |
|
加入稀盐酸质量/g |
10 |
10 |
10 |
10 |
|
剩余固体的质量/g |
9.10 |
8.45 |
7.80 |
7.80 |
请你计算:
(1)所用稀盐酸中溶质的质量分数。
(2)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量。
(3)黄铜样品中铜的质量分数。
【解】设参加反应的HCl 的质量为x
Zn的质量= 0.65g × 3 = 1.95g
Zn + 2HCl ZnCl2+H2↑
65 73
1.95g x
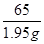 =
= 或
或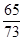 =
=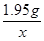
x = 73×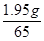 = 2.19g
= 2.19g
稀盐酸中溶质HCl的质量分数= 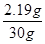 × 100% = 7.3%……………………1分
× 100% = 7.3%……………………1分
需要浓盐酸的质量= 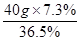 = 8g………………………………………1分
= 8g………………………………………1分
黄铜中铜的质量分数= 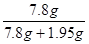 × 100% = 80%………………………1分
× 100% = 80%………………………1分
答:稀盐酸中溶质HCl的质量分数为7.3%,需要浓盐酸的质量为8g,黄铜中铜的质量分数为80%。(其他方法合理给分)
【解析】
试题分析:根据题中数据可知,第一次加盐酸反应掉的锌的质量与第二次、第三次反应的锌的质量相等,都是0.65克。故样品中锌的质量为:0.65g × 3 = 1.95g;
设:反应中共用去HCl的质量为x。
Zn + 2HCl ZnCl2+H2↑
65 73
1.95g x
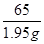 =
= 或
或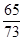 =
=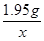
x = 73×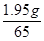 = 2.19g
= 2.19g
稀盐酸中溶质HCl的质量分数= 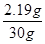 × 100% = 7.3%
× 100% = 7.3%
(2)浓盐酸稀释成稀盐酸后,HCl的质量不变。
需要浓盐酸的质量= 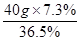 = 8g
= 8g
(3)黄铜样品中铜的质量分数=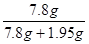 × 100% = 80%
× 100% = 80%
考点:根据化学方程式计算;质量分数的计算。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。
浓溶液稀释成稀溶液后,溶质的质量不变。


科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第二次 | 第四次 | |
| 加入稀盐酸质量(g) | 10g | 10g | 10g | 10g |
| 剩余固体的质量(g) | 8.7g | 7.4g | 6.1g | 5.45g |
| 65 |
| 2 |
| 4.55g |
| X |
| 65 |
| 2 |
| 4.55g |
| X |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验次数 | 1 | 2 | 3 | 4 |
| 稀盐酸的用量 | 10g | 10g | 10g | 10g |
| 剩余固体的质量 | 8.7g | 7.4g | 6.7g | 6.7g |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com