A
分析:设该混合物为+2价金属混合物,为能够和硫酸反应的,通过计算求出平均相对原子质量.然后分析给定选项.
解答:当金属混合物设定为+2价金属时,假设都能反应.设混合物为M,相对原子质量为x.
M+H
2SO
4=MSO
4+H
2↑
x 2
12g 1g
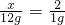
x=24.
若两种金属都反应,且本身都是+2价金属,则必须有一个的相对原子质量小于24,一个的相对原子质量大于24,由于铝为+3价金属,相对原子质量为27,当折合为+2价金属时,铝可以理解为相对原子质量为18.镁的相对原子质量为
24.
若一种金属反应,而一种不反应,则反应的金属的相对原子质量小于24.
A、由于铝为+3价金属,相对原子质量为27,当折合为+2价金属时,铝可以理解为相对原子质量为18,相当于二价的Al的相对原子质量小于24,铁的原对原子质量为56大于24,故A正确.
B、Fe和Zn的相对原子质量都大于26,故B错误;
C、Mg的相对原子质量为24,铜与酸不反应,故C错误.
D、Mg的相对原子质量为24,锌的相对原子质量为65,大于24,故D错误;
故选A.
点评:本题主要考查金属活动性顺序和化学方程式的计算,熟记金属的活动性顺序,掌握有关化学方程式计算的原理和方法,问题就会迎刃而解



 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案