
����Ŀ��ͬѧ������װ��ʣ�µĴ���ʯ��Ƭ�������ʵ�顣
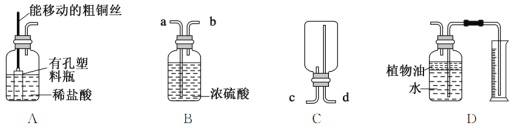
��1��һλͬѧ�����װ��A��ȡCO2����װ����ͨ�������ƶ����������Ĵ�ͭ˿�����Ʒ�Ӧ�ķ�����ֹͣ������ʯ��ƬӦ�����п�����ƿ�У�A�з�Ӧ�Ļ�ѧ����ʽΪ_____��
��2��ŨH2SO4����ǿ�ҵ���ˮ�ԣ�����Ϊ�������ȥijЩ�����е�ˮ�֣�����װ��B����CO2����CO2Ӧ��_____(����ĸ)��ͨ�롣
��3������װ��C�ռ�CO2����CO2Ӧ��_____(����ĸ)��ͨ�롣
��4��װ��D����ͨ��CO2��ˮѹ����Ͳ���Բ���CO2�������ֲ���͵�������_____
��5��д��������̼��ˮ��Ӧ�Ļ�ѧ����ʽ_____
���𰸡�![]() a c ��ֹ������̼����ˮ
a c ��ֹ������̼����ˮ ![]()
��������
ϡ�����̼��Ʒ�Ӧ����̼��ƺ�ˮ�Ͷ�����̼��������̼�ܶȱȿ�����������ˮ���ռ������������ſ�������ŨH2SO4����ǿ�ҵ���ˮ�ԣ��ɸ����������壬������̼��ˮ����̼�ᡣ
��1��һλͬѧ�����װ��A��ȡCO2����װ����ͨ�������ƶ����������Ĵ�ͭ˿�����Ʒ�Ӧ�ķ�����ֹͣ������ʯ��Ƭ��Ҫ�ɷ���̼��ƣ�Ӧ�����п�����ƿ�У�ϡ�����̼��Ʒ�Ӧ����̼��ƺ�ˮ�Ͷ�����̼��A�з�Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��2��ŨH2SO4����ǿ�ҵ���ˮ�ԣ�����Ϊ�������ȥijЩ�����е�ˮ�֣�װ��B����CO2����CO2Ӧ��a��ͨ�롣
��3��������̼�ܶȱȿ�����������ˮ���ռ������������ſ�����������װ��C�ռ�CO2����CO2Ӧ�ӳ���ͨ�롣
��4��װ��D����ͨ��CO2��ˮѹ����Ͳ���Բ���CO2�������ֲ���͵��ܶȱ�ˮС��Ư����ˮ�棬�Ҳ���������Ӧ���������Ƿ�ֹ������̼����ˮ��
��5��������̼��ˮ��Ӧ����̼�ᣬ�ʻ�ѧ����ʽΪ![]() ��
��


 �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д� ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)С���ڰ���ʦ����ʵ����ʱ,����һƿδ�ܷ��NaOH����,����ɷ�������¼���,������ʦ��ָ���½���ʵ��̽��
���������ϣ�:��NaOH��¶�ڿ������ױ���������ѧ����ʽ����NaOH���ʵ�ԭ��_____
��Na2CO3��Һ�ʼ���,BaCl2��ҺNaCl��Һ������
��������裩:����I:ֻ��NaOH;�����:��NaOH��Na2CO3;�����:ֻ��Na2CO3
������ʵ�飩:
ʵ��������� | ʵ������ | ʵ����� |
��ȡ������Ʒ���Թ���,����������ϡ���� | �����ݲ��� | ����_____����ȷ |
����ȡ������Ʒ���Թ���,��ˮ�ܽ�,���� ������BaCl2��Һ,��,���� | _____ | �������ȷ |
��ȡ�����ϲ���Һ,�μ���ɫ��̪��Һ | _____ |
���������ۣ�:������м������BaCl2��Һ��������_____,�罫����BaCl2��Һ����Ba(OH)2��Һ,ʵ���ܷ�ɹ�?_____(��ܡ����ܡ�),ԭ����_____
(2)С��Ϊ�˲ⶨһƿδ�ܷⱣ���Ѳ��ֱ��ʵ�NaOH������NaOH����������,���ó������������²���:��ȡ15����Ʒ���ձ���,������ˮ�����Һ;
������Ʒ��Һ�м���������BaCl2��Һ;
�۴���Ӧ��ȫ��,�����й����ݼ�¼���±�:
��Ӧǰ | ��Ӧ�� | |
�ձ�����Ʒ��Һ������/g | �����Ȼ�����Һ����/g | ���˺��ձ�����Һ������/g(��Һ����ʧ���Բ���) |
95 | 65 | 140.3 |
��ش���������:
���ڷ�Ӧǰ�����Һ��,����Ԫ���������ֲ������_____
A��Ԫ�� B̼Ԫ�� C��Ԫ�� D��Ԫ��
��ԭ��Ʒ��NaOH�����������Ƕ���?(д���������)_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��ͬѧ���֣������ǵ���ǩ�ڿ����в��Ḵȼ������װ��60%ˮ�ļ���ƿ������ˮ�����ռ������õ���������ʹ�����ǵ���ǩ��ȼ��Ϊ���ҵ���ʹ��������ǩ��ȼ������������Сֵ�����ǽ���������̽����
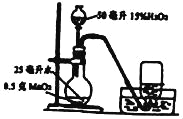
(1)�����ʵ�飩С��Aͬѧ�������ͼ��װ�ã���װ�õ�Բ����ƿ�з���25����ˮ��Ŀ����_______������MnO2��Ŀ����_______��д����ƿ�з����ķ�Ӧ�ķ���ʽ_______��
(2)��ʵ���о�����һ��ʵ�飺ȡ3ֻ����ƿ�����Ϊ�٢ڢۣ��ֱ�װ��15%��30%��45%��ˮ�����ϸDz�Ƭ������ˮ���С�������_______�ų����ܿ����뼯��ƿ�����е�ˮȫ���ų�������ͬ��3֧��������ǩ�ֱ����١��ۺ�ƿ�У���¼ʵ������
��õ�һ��ʵ�������С��ͬѧA�����˵ڶ���ʵ�飬����¼ʵ����������ʵ�����ݺ����������
ʵ����� | ��һ�� | �ڶ��� | ||||
ʵ����� | �� | |||||
����ƿװˮ��������� (%) | 15 | 30 | 45 | 34 | 38 | 42 |
��������ǩ״�� | �� | ���� | ��ȼ | ���� | ��ȼ | ��ȼ |
(3)�ó���������ʵ�������С��Bͬѧ��Ϊ������ȷ����ʹ��������ǩ��ȼ������������Сֵ�����������ʵ�顣��ʵ����Ţߵļ���ƿװˮ���������Ӧ����_______%
(4)��ʵ����ۣ��پ�������ʵ�鲢�����ó�����ʹ��������ǩ��ȼ������������СֵΪ48.7%������д��������̵ļ���ʽ_______�� (ǡ�ø�ȼʱ����ƿװˮ�����������X%)
(5)������̽����С��Cͬѧ��Ϊ���ø÷����ռ��������к���һ������ˮ�������������ʵ��Ľ��Ĵ�ʩ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾʵ���������ȷ���ǣ�������
A.  ����������������B.
����������������B. 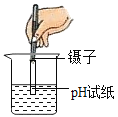 ����ҺpH
����ҺpH
C.  ������ҺD.
������ҺD.  ϡ��Ũ����
ϡ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һƿ��ǩ����ʴ�����ᣬС��Ϊ�˲ⶨ��Һ�����ʵ��������������ձ���������8g10%��NaOH��Һ��Ȼ�����ձ��еμӸ����ᣮ��Ӧ��������Һ��pH����������������ϵ��ͼ��ʾ����ش��������⣺

��1����pHΪ4ʱ��Һ�е�������_____��
��2�����㵱pH�պ�Ϊ7ʱ������Һ����������������_____��д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�С����ʵ������MnO2����Ϊԭ����ȡ����MnCO3�������������£�

��֪��MnSO4��MnCl2��������ˮ��MnCO3������ˮ����100��ʱ��ʼ�ֽ⡣
��1����Ӧ��Ϊ���Ϸ�Ӧ������ΪMnSO4���÷�Ӧ�Ļ�ѧ����ʽΪ_______�����������в�����MnSO4��Ӧ����_______��
A��ϡ���� B��BaCl2 C������ D��Na2CO3
��2������aҪ�õ���ʵ����Ʒ�У������������⣬����_____��������ʵ����Ʒ����
��3����ƷMnCO3(��) ��MnCO3(��) ��������ԭ���Dz�ƷMnCO3(��) ����ϴ�ӡ�����Ժ��渽�ŵ�H2O��__________���ѧʽ���������ѱ���ȥ��
��4��Ϊ�˻�ô�����MnCO3�����ʱ��Ҫ���Ƶ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�ֳ��о�����ʹ�õ�ȼ����Ҫ�ǹܵ�ú������Ȼ�����ܵ�ú������Ҫ�ɷ���CO��H2���������࣬��Ȼ������Ҫ�ɷ���CH4�����ǵ�ȼ�շ�Ӧ���£�
2CO+O2![]() 2CO2��2H2+O2
2CO2��2H2+O2![]() 2H2O ��CH4+2O2
2H2O ��CH4+2O2![]() CO2+2H2O
CO2+2H2O
��1���������ϻ�ѧ����ʽ�жϣ���ͬ�����£�ȼ����ͬ����Ĺܵ�ú������Ȼ�������Ŀ�������ϴ����__________�����ȼ�չܵ�ú����������������Ȼ������ߵĸĽ�������______����ڣ������С�������粻�Ľ����ܲ����IJ��������___________��
��2����ͥú���ܳ���Ӳ�ʾ�����ϩ�;���ϩ���Ϲܣ����Ϲ�����_______���ϡ�
��3���ܵ�ú���к��е����࣬����������������顢���顢����ȵ�ijЩ���ʼ��±���
���� | ���� | ���� | |
�۵�/�� | -183.3 | -189.7 | -183.4 |
�е�/�� | -88.6 | -42.1 | -0.5 |
�Ը�������ij���ؼ����ݽ��Ͷ����Ϻ�������ʱ�ܵ�ú�������С�����ҳʶ���״̬��ԭ���ǣ�________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��F�dz��л�ѧ�������������ʣ�����֮���ת����ϵ��ͼ��ʾ����������ʾ����֮���ת����ϵ����һ����ʾ�������ʿ������Ӧ�����ַ�Ӧ������P��Ӧ����δ���������֪BΪθ�����Ҫ�ɷ֣�A��F�Ǻ���ͬ�����ӵ��Σ���F��ҺΪ��ɫ��C��Ҫ�ɷֿ����ڽ������ϣ��Իش��������⣺
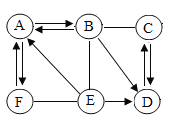
��1��д��B��D�Ļ�ѧʽ��B_____��D_____��
��2��д��A��B��Ӧ�Ļ�ѧ����ʽ_____��
��3��д��F��E��Ӧ�Ļ�ѧ��Ӧ����ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����������ۣ�������Դʮ�ַḻ��
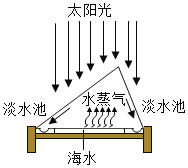
(1)��ͼ��ʾ���Ӻ�ˮ�л�õ�ˮ�ķ�����______������Ϊ�ü������ŵ���______��
(2)�Ӻ�ˮ����ȡ����þ���ɰ���ͼ��ʾ���̽��У�

��д�����������Ӧ�Ļ�ѧ����ʽ______��
�ڸ�������ͼ������˵����ȷ����______(ѡ����ĸ���)��
A�������ͨ��һ����Ӧ����ʵ��
B���������Ŀ���ǴӺ�ˮ���ᴿ�Ȼ�þ
C������������кͷ�Ӧ
D��������л�ѧ��ת��Ϊ����
(3)�ҹ�������ѧ�Һ�°������������Ƽ����Ҫ��������ʾ��ͼ���£�
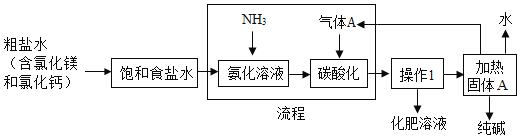
��Ϊ�˳�ȥ����ˮ�п��������ʣ��ɼ����������ʣ����ù��˵Ȳ������г��ӣ�����������������ʵ��Ⱥ�˳��Ϊ______��
a���Թ�����Na2CO3��Һb������������c���Թ�����Ba(OH)2��Һ
������һ��������Һ����Һ��pH______7(ѡ��������������������=��)���Ӷ���������������A������һ��Ӧ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com