
 甲、乙同学在学完酸的化学性质后,做了如图所示实验:实验结束后,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论.
甲、乙同学在学完酸的化学性质后,做了如图所示实验:实验结束后,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论.分析 【观察与讨论1】向氢氧化钙溶液中应先滴几滴酚酞试液,则溶液为红色,如果红色消失,则说明反应;
【观察与讨论2】无论氢氧化钙和稀盐酸是否恰好完全反应,形成的溶液中一定含有氯化钙;
无论碳酸钠和稀盐酸的质量如何,形成的溶液中一定含有氯化钠;
【猜想与假设】如果物质之间恰好完全反应时,废液中含有氯化钙和氯化钠;
如果稀盐酸过量时,废液中含有氯化钙、氯化钠和氯化氢;
如果稀盐酸不足,废液中含有氢氧化钙、氯化钙和氯化钠;
【结论与反思】根据实验现象可以判断废液中溶质的组合情况;
【表达与交流】碳酸钙可与盐酸反应并除去盐酸,铁与盐酸反应生成氯化亚铁和氢气.
解答 解:【观察与讨论1】
酚酞溶液遇碱性溶液会变红;而在中性或酸性溶液中显示无色;酚酞溶液可鉴别碱是否被中和;
故答案为:滴加几滴酚酞试液.
【观察与讨论2】甲同学的试管中废液含有的溶质一定有氯化钙,化学式是CaCl2;
乙同学的试管中废液含有的溶质一定有氯化钠,化学式是NaCl.
故答案为:CaCl2;NaCl.
【猜想与假设】
猜想1:废液中含有CaCl2、NaCl两种溶质;
猜想2:废液中含有Ca(OH)2、CaCl2、NaCl三种溶质;
猜想3:废液中含有CaCl2、NaCl、HCl.
故填:Ca(OH)2、CaCl2、NaCl;
【活动与探究】
甲同学实验:取少量废液于试管中,向其中滴加酚酞溶液,溶液不变红,说明溶液中含没有氢氧化钙.
乙同学实验:取少量废液于试管中,向其中加入铁钉,有气体生成,说明溶液中不含有盐酸;
【结论与反思】
由以上分析可知,猜想3正确.
故填:3.
【表达与交流】不用指示剂的情况下使该废液变为中性可向废液中加入足量的碳酸钙粉末;
铁与盐酸反应产生氯化亚铁和氢气,反应的方程式为:Fe+2HCl═FeCl2+H2↑;
故答案为:向废液中加入足量的碳酸钙粉末;Fe+2HCl═FeCl2+H2↑.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 空气是由多种气体与液体、固体组成的复杂物质 | |
| B. | 空气的成分按体积计算,氧气占21% | |
| C. | 空气的成分中除了氮气、氧气外,最多的是稀有气体 | |
| D. | 林区空气比城市空气含有更多的二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 方案一 | 方案二(数字化实验) |
 | 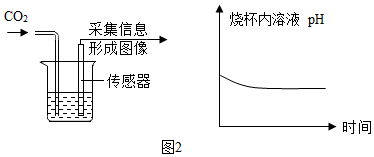 |
| 方案一 | 方案二(数字化实验) |
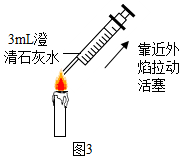 |  |
| 方案一 | 方案二(数字化实验) |
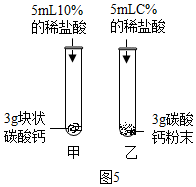 | 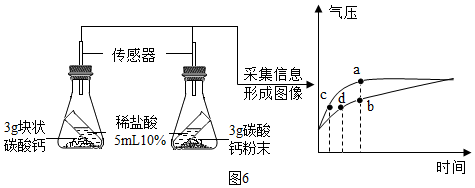 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某家长带小孩在下水道井盖小孔上点燃鞭炮发生了爆炸.现要探究某下水道的可燃性气体的成分::
某家长带小孩在下水道井盖小孔上点燃鞭炮发生了爆炸.现要探究某下水道的可燃性气体的成分::| 步骤 | 现象 | 结论 |
| 用吸附少量无水硫酸铜粉末的石棉贴在小烧杯内壁,再把小烧杯斜罩于火焰上方 | 无水硫酸铜 变蓝 | 证明有水生成 |
| 用内壁沾有澄清石灰水的小烧杯罩于火焰上方 | 烧杯内澄清石灰水变浑浊 | 证明有二氧化碳生成 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 尼古丁由三种元素组成 | |
| B. | 尼古丁是由10个碳原子、14个氢原子、2个氮原子构成 | |
| C. | 1个尼古丁分子含有26个原子 | |
| D. | 尼古丁中含有氮分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com