
在稀硫酸和硫酸铜的混合溶液中,加入适量铁粉,使其恰好反应。,.则原混合溶液中硫酸和硫酸铜的质量比为
| A.7:80 | B.1:1 | C.7:40 | D.49:80 |
试题分析:铁与稀硫酸反应使得加入的固体质量减少,铁与硫酸铜溶液反应生成铜,使得加入的固体质量增加,由题目“反应后得到的固体质量与所加铁粉质量相等”知:与稀硫酸、硫酸铜反应的铁的质量总和和与硫酸铜溶液反应生成的铜的质量相等。
全题假设反应生成铜64g.。
1.根据下列化学方程式可求出与硫酸铜反应掉的铁的质量X,硫酸铜的质量Y
Fe+CuSO4=Cu+FeSO4
56 160 64
X Y 64g
X =56g Y=160g
2.由此可知:与稀硫酸反应的铁的质量为64-56=8g,再根据下列化学方程式可计算出稀硫酸的质量M
Fe+H2SO4=FeSO4+H2↑
98
8g M
M=14g


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| △ |
| ||
| △ |
| 猜想 | 主要操作 | 主要现象 | 实验结论 |
| 猜想一 | 打磨R丝,并将其插入到硫酸铜溶液中 | R丝表面覆盖了一层红色的物质 | 猜想一 不成立 不成立 (填“成立”或“不成立”) |
| 猜想二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中 | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色 ②铝丝表面产生气泡较快 ③铜丝表面没有气泡产生 |
猜想二成立. R与稀硫酸反应的化学方程式为 R+H2SO4═RSO4+H2↑ R+H2SO4═RSO4+H2↑ |
| 猜想三 | 将打磨过的铝丝插入到RSO4[或RCl2或R(NO3)2]溶液中 将打磨过的铝丝插入到RSO4[或RCl2或R(NO3)2]溶液中 |
无明显现象 | 猜想三成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
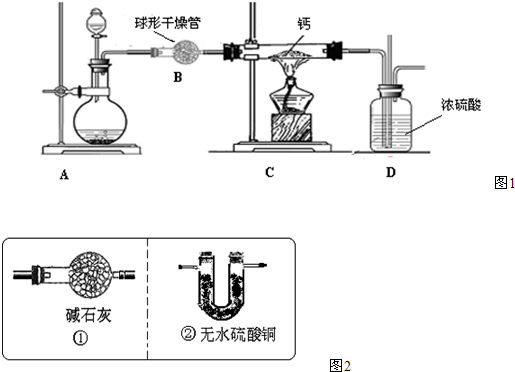
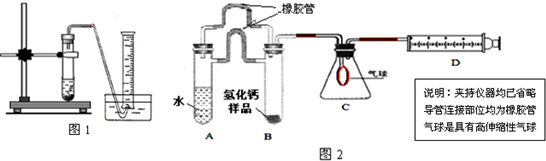
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
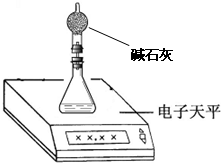
 氢氧化铜固体受热分解能得到两种氧化物,一种为固体,另一种是无色液体.某化学活动小组为确定这种固体产物是什么,进行了如下探究活动.
氢氧化铜固体受热分解能得到两种氧化物,一种为固体,另一种是无色液体.某化学活动小组为确定这种固体产物是什么,进行了如下探究活动.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com